-
多能干细胞
 多能干细胞
多能干细胞
多能干细胞(Stem Cells)是一类具有自我更新、自我复制能力的多潜能细胞。在一定条件下,它可以分化成多种APSC多能细胞,多能干细胞(Ps)具有分化出多种细胞组织的潜能,但失去了发育成完整个体的能力,发育潜能受到一定的限制。
目录
- 1 基本信息
2 信息简介
3 来源
4 中国研究
5 诱导干细胞
6 奇兵突围
7 潜在应用
基本信息
中文名:多能干细胞
能力:具有分化出多种细胞组织的潜能
性质:分化出至少十二种血细胞
外文名:Ps
例子:骨髓多能造血干细胞
信息简介
多能干细胞(Pluripotent stem cell,Ps)是当前干细胞研究的热点和焦点。它可以分化成体内所有的细胞,进而形成身体的所有组织和器官。因此,多能干细胞的研究不仅具有重要的理论意义,而且在器官再生、修复和疾病治疗方面极具应用价值。但是过去认为多能干细胞只能从人胚胎中获得。
多能干细胞(pluripotent stem cell),具有分化出多种细胞组织的潜能,但失去了发育成完整个体的能力,发育潜能受到一定的限制。骨髓多能造血干细胞是典型的例子,它可分化出至少十二种血细胞,但不能分化出造血系统以外的其它细胞。 2009年6月3日中国科学家肖磊领导的科研小组首次从猪的体细胞中培育出多能干细胞,这也是世界上首次提取出家养有蹄类动物的多能干细胞。
2007年,美国和日本科学家发现,应用人和鼠的正常皮肤细胞,导入KLF4、OCT4、SOX2和C-MYC四种基因,即可由正常体细胞转化成多能干细胞。这种基因诱导而产生的多能干细胞称为诱导多能干细胞(iPs)。除了皮肤细胞,像其他APSC多能细胞实验室等其他体细胞也可以产生iPs。应用iPs已经成功培养和分化出心肌、神经、胰腺、骨等多种体细胞和不同的组织。但是,过去诱导多能干细胞必须应用逆转录病毒载体才能进行基因组整合。由于基因组整合的随机性,可发生突变,甚至可以引起癌症和遗传疾病。哈佛干细胞研究中心和麻省医院肿瘤中心的科学家,成功应用无害基因组整合病毒载体(重组腺病毒载体),进行以上四种基因转移,成功地将成纤维细胞和肝细胞分化成多能干细胞,成为Adeno-iPs,将干细胞的实际应用又大大向前推进了一步。多能干细胞研究和应用将会成为21世纪最伟大的医学生物学成就之一。
具有发育成多个胚层细胞的能力。
实际上,真正意义上的哺乳动物全能干细胞只有受精卵和卵裂早期细胞。它们不仅可以分化产生三胚层中各类型细胞,还能发育成胎盘组织,最终产生子代个体。多能干细胞通常在一定条件下,能分化产生3个胚层中各种类型细胞并形成器官的一类细胞。小鼠的胚胎干细胞在体内和体外都可以分化产生3个胚层的各种细胞类型,当移植到发育的胚囊中后,还可以发育成新生的个体。因此有人认为,胚胎干细胞也是一种全能的干细胞。但如果将其植入到子宫中,由于不能分化成胚外组织,所以无法发育成正常个体。
来源
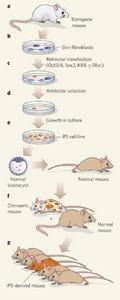 多能干细胞的简单获得
多能干细胞的简单获得
(2) 与此相反,Dr. Gearheart从终止妊娠的胎儿组织中分离出多能性干细胞。捐献者自行决定了终止妊娠,从他们那儿获得了知情同意书后,Dr. Gearheart从原本要发育成睾丸或卵巢的胎儿部位取得细胞。尽管Dr. Thomson 实验室和Dr. Gearheart实验室使用的细胞系来源不同,但发育成熟的细胞看起来非常相似。
体细胞核转移(SCNT)是得到多能性干细胞的另一种途径。在SCNT的动物研究中,研究者将一个正常的动物卵细胞去除细胞核(含染色体的细胞结构)。存留在卵细胞内的物质含营养成分和对胚胎发育非常重要的能量物质。而后,在非常精细调控的实验室条件下,将单个体细胞——除卵细胞或精子细胞之外的任一种细胞——与除去核卵细胞放在一起,使两者相融合。融合细胞以及其子细胞具有发育成一个完整个体的潜能,因此是全能性的。正如图I所示,这些全能性细胞不久将形成胚囊,从理论上来说,可利用胚囊的内细胞群来建立多能性干细胞系。实际上,任何一种可生成人类胚囊细胞的方法都有可能成为人体多能性干细胞的来源。
中国研究
肖磊是中国科学院上海生命科学研究院生物化学与细胞生物学研究所科研人员。他和吴昭、陈霁君等同事成功运用可诱导(Tet-on/off系统)的慢病毒表达系统表达转录因子,从而把猪成体细胞成功地重编程到多能干细胞状态。经过进一步筛选、鉴定,最终获得符合多能干细胞标准的猪iPS细胞系(诱导多能干细胞系)。这些细胞系形态类似人类胚胎干细胞,具有跟人类胚胎干细胞类似的干细胞标记基因的表达,有很高的端粒酶活性,并具有正常的核型,而且在体外和体内都具有向内、中、外三个胚层分化的能力。
肖磊表示,这是世界首次培育出有蹄类动物的多能干细胞。在此之前,无论是通过生殖细胞还是体细胞,人们都没能从猪身上成功培育出多能干细胞。这一研究成果对人类和动物的健康具有广泛的意义。
人工培育猪干细胞的医学应用,还需要若干年时间才能投入临床使用。
这是全世界首次使用有蹄脚的动物即有蹄类动物的体细胞,而非精细胞或卵细胞实现了这一成果。该成果可以为建立人类遗传病模型、培育供人类器官移植的转基因动物,及养殖耐受猪流感等疾病的猪开辟道路。该研究成果发布于新创刊的《分子细胞生物学报》。
诱导干细胞
IPS(Induced Pluripotent Stem Cells )
iPS技术是干细胞研究领域的一项重大突破,它回避了历来已久的伦理争议,解决了干细胞移植医学上的免疫排斥问题,使干细胞向临床应用又迈进了一大步。随着iPS技术的不断发展以及技术水平的不断更新,它在生命科学基础研究和医学领域的优势已日趋明显。
美国哈佛大学研究人员采取添加特殊化合物的方法,将体细胞制造IPS的效率提高了100多倍。这项研究在大鼠实验中已获得成功,而在制造人类IPS时也可采取同样方法,以提高效率。该成果被业界称为IPS研究中的一大进步。
IPS是由一些多能遗传基因导入皮肤等细胞中制造而成。在制造过程中,美国研究人员使用了4种遗传基因,同时加入了7种包括可阻碍特定蛋白质合成的物质和酶在内的化合物,以研究其各自的制造效率。研究结果显示,没有添加化合物时,遗传基因的导入效率为0.01%—0.05%,而加入了一种叫“巴尔普罗酸”的蛋白质合成阻碍剂之后,导入效率竟升至9.6%—14%。
如果从这4种遗传基因中排除导致细胞癌化的遗传基因,只使用3种基因,过去的导入效率只有0.001%甚至更低,而加入“巴尔普罗酸”之后,其效率也提高了约50倍。研究人员认为,这很可能是因为“巴尔普罗酸”可以促进多能遗传基因的活性。今后,研究人员将就添加化合物是否会使遗传基因产生变异展开研究,以在提高制造效率的同时保证安全性。
奇兵突围
英国《自然》杂志和美国《细胞?干细胞》杂志日前分别报道了中国科学家首次利用iPS细胞培育出活体小鼠的消息,《自然》杂志称这一成果“为克隆成年哺乳动物开辟了一条全新道路”。克隆小鼠本身并不稀奇,而中国科学家的研究成果如此备受关注,关键在于克隆实验所用的新型全能细胞――iPS细胞。
iPS细胞又称诱导多功能干细胞,其神奇之处要从胚胎干细胞说起。胚胎干细胞一直是干细胞研究中的大明星,因为它能分化成各种器官细胞,具有最广泛的发展潜力。从技术角度来说,“全能性”的胚胎干细胞对于治疗性克隆来说是最理想的。
然而,由于人类胚胎干细胞研究触及伦理和道德,在很多国家被法律禁止,相关研究也处于进退两难的境地,干细胞研究亟待突围。
2007年,日本和美国科学家分别宣布发现将普通皮肤细胞转化为干细胞的方法,这样得到的干细胞和具有与胚胎干细胞类似的功能,被称为诱导多功能干细胞,又名iPS细胞。这一发现分别被《自然》和《科学》两大权威科学杂志评为当年重大科学进展。
iPS细胞是“初始化”后的普通体细胞,但具有和胚胎干细胞类似的功能,能分化生成各种组织细胞。更重要的是,它绕开了胚胎干细胞研究一直面临的伦理和法律等诸多障碍,医疗领域的应用前景非常广阔。这一发现在克隆研究领域无异于“奇兵突围”。美国、日本等许多国家更是以极大热情,或加大投入,或制订鼓励政策,推动这一新兴的干细胞研究。
但是,由于此前未能培育出完全由iPS细胞发育而来的活体哺乳动物,其全能性一直受到怀疑。它是否能与胚胎干细胞媲美,在医疗应用领域大显身手呢?有关验证性研究一直进展不大。
上海交通大学研究员曾凡一女士参与了iPS细胞克隆鼠的研究,她对新华社记者说,用iPS细胞能否培育出小鼠正是验证它是否具有全能性的“黄金标准”。先前国际上的相关研究始终未能成功,用iPS细胞培育的小鼠均胎死腹中。
此次,两支中国科研队伍在世界iPS细胞研究中率先突破。中科院动物研究所周琪和北京生命科学研究所高绍荣的研究团队分别利用iPS细胞克隆出小鼠,从而在世界上首次证明了iPS细胞的全能性。
周琪在接受新华社记者采访时说,事实上,中国干细胞基础研究和应用研究起步较早,2001年后,与干细胞相关的重大研究项目不少于20个。此外,国家还在研发网络建设、人才建设、研究平台搭建等方面给予了大力支持,为中国在该研究领域的优势地位奠定了基础。
高绍荣也向新华社记者表示,iPS细胞具有全能性说明,完全通过体外操作可得到与胚胎干细胞具有同样分化能力的细胞,这将大大拓展iPS细胞的应用前景。这项成果是从干细胞研究迈向实际医疗过程中的一大步,对干细胞全能性的机理研究以及器官移植、药物筛选、基因治疗等临床应用研究具有重要价值。
人们完全有理由期待,在一系列危险和潜在危险被一一规避后,尚处在实验室阶段的iPS细胞研究,将能很快应用于人类疾病的治疗。
潜在应用
 多能干细胞分化出的运动神经
多能干细胞分化出的运动神经
上海生科院等揭示多能干细胞在阿尔茨海默病细胞替代治疗中的应用
10月15日,国际学术期刊Stem Cell Reports在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所景乃禾研究组的研究论文:Embryonic stem cell-derived basal forebrain cholinergic neurons ameliorate the cognitive symptoms associated with Alzheimer’s disease in mouse models。该论文成功地把小鼠和人胚胎干细胞诱导分化为成熟的功能性基底前脑胆碱能神经元(Basal forebrain cholinergic neuron,BFCN),将这些干细胞来源的BFCN移植到阿尔茨海默病动物模型脑内,可以有效改善模型小鼠的认知功能。该项研究将有助于探讨多能干细胞来源的基底前脑胆碱能神经元用于阿尔茨海默病细胞治疗的可行性,并为基于多能干细胞的阿尔茨海默病细胞替代治疗提供理论依据。
阿尔茨海默病(Alzheimer’s disease,AD)是严重危害人类健康,特别是老年人身体健康和生活质量的重大疾病。AD的治疗主要依赖于药物来延缓认知功能的衰退,效果非常有限。近年来,基于多能干细胞的细胞替代治疗在神经退行性疾病上的应用取得一定进展,然而多能干细胞在AD细胞替代治疗中的应用还少有研究。已有的研究证实,与认知活动密切相关的BFCN的功能异常和丢失是导致AD病人认知功能障碍的重要原因,因此BFCN可能具有改善AD认知功能障碍的潜能。但是,从多能干细胞定向诱导分化为BFCN的研究刚刚起步,干细胞来源的BFCN在AD细胞替代治疗中的应用和功能还很不清楚。
在该项研究中,生化与细胞所景乃禾研究组工作人员岳伟、李媛媛和张婷等将小鼠和人多能干细胞诱导分化为基底前脑胆碱能神经元(Basal forebrain cholinergic neuron,BFCN),并发现这些多能干细胞来源的BFCN具有与脑内BFCN相似的分子和功能特征。在此基础上,他们将小鼠和人多能干细胞来源的BFCN前体细胞移植到AD模型小鼠的基底前脑内,发现移植细胞在AD小鼠基底前脑内主要分化为有功能的乙酰胆碱能神经元,并能有效整合到AD小鼠基底前脑的乙酰胆碱能投射环路。同时发现,移植外源BFCN的AD小鼠的学习和记忆功能得到了显著的改善。这一研究工作是通过与北京师范大学舒友生研究组和上海生科院神经科学研究所于翔研究组合作完成。
该研究项目得到了科技部、国家自然科学基金委和中国科学院的资助。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













