-
二硫化铁
 二硫化铁
二硫化铁
二硫化铁,通称二硫化亚铁(ferrous disulfide),化学式FeS2。在自然界中主要以两种矿物存在:黄铁矿和白铁矿。白铁矿属于正交晶系,其禁带宽度(Eg=0.34 eV)较窄,不适合光电有效转换过程;黄铁矿最常见,是一种黄色立方晶体、无味,晶体属等轴晶系的硫化物矿物之一,生产硫酸所用的原材料主要是黄铁矿。成分中通常含钴、镍和硒,具有AB2的典型立方结构,结构类似NaCl,Fe原子位于单胞的角顶和面心。哑铃型的S2原子位于立方体单胞的12条棱上,不易分散。天然二硫化亚铁存在三种晶型,即立方体、八面体、五角十二面体及其聚形等,前两种晶型含量很高,后一种含量很低。由于各种晶型二硫化亚铁的分子结构式都属AB2,因此其物理化学性质相同,通过物理和化学方法分离很难。
目录
- 1 基本信息
2 理化性质
3 分布情况
4 应用领域
5 毒理危害
6 储存条件
基本信息
中文名:二硫化铁
别称:黄铁矿、白铁矿、矿铁矿、二硫化亚铁
分子量:119.967
EINECS登录:235-106-8
MDL号:MFCD00064690
危险性符号:F;Xi
英文名:ferrous disulfide
化学式:FeS₂
CAS登录号:12068-85-8
熔点:725℃
安全性描述:S26;S36/37/39;S61
危险性描述:R32;R36/37/38
理化性质
 硫化铁晶体
硫化铁晶体
性状:黄色立方晶体。
熔点:1171 ℃
密度:5.0 g/cm
溶解性:不溶于水和稀盐酸,溶于硝酸并有硫磺析出
化学性质
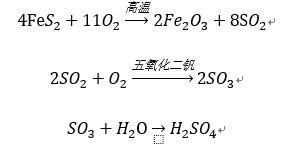 氧化反应生成三氧化二铁、二氧化硫、硫酸反应方程式
氧化反应生成三氧化二铁、二氧化硫、硫酸反应方程式
存在方式
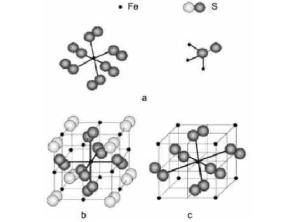 (a)阴阳离子配位形式; (b)立方晶系黄铁矿; (c)斜方晶系白铁矿
(a)阴阳离子配位形式; (b)立方晶系黄铁矿; (c)斜方晶系白铁矿
从黄铁矿化学组成方面分析其存在方式,一般而言,对于天然的黄铁矿,硫偏离理想组分的量(质量百分数)在1.3 %以下,即对应于FeS2-x(x≤0.07)。在水存在的情况下,很容易发生如下氧化反应:
2FeS2+O2+2H2O→2FeSO4+2H2SO4
其中间产物有硫代硫酸盐、亚硫酸盐和硫等。由于黄铁矿的摩尔体积比硫元素小,因此在氧化过程中产生的硫等不会导致表面膨胀,生成的表面氧化物可以有效防止继续氧化。
分布情况
中国硫资源构成与世界硫资源相比有较大差别。在世界硫资源构成中,石油与天然气中硫占较大比例,是硫的主要来源。与世界硫资源相比,中国石油多数为低硫油,酸性天然气主要产于四川威远一带的气田中,油气中硫资源量合计占中国硫资源量的0.12%。而中国的硫铁矿资源在世界上的丰富程度却居首位,遥遥领先于世界其他所有国家;除单独的硫铁矿、伴生硫铁矿外,煤系中的硫资源也主要是以硫铁矿的形式存在,仅这三部分硫铁矿资源量就占中国硫资源量的83.4%。我国硫铁矿保有储量达数十亿吨,平均品位为18.28 %。硫铁矿品位高于35 %的富矿仅占总储量的4.5 %;绝大部分属于含硫12~35 %的中低品位矿石,且含硫12~20 %的贫矿所占比重较大。著名的向山硫铁矿的入选品位仅含硫10 %,因此大量被视作废石的表外矿也被利用。著名产地还有广东英德和云浮、安徽马鞍山、甘肃白银厂等。
从中国硫储量来看,硫储量由硫铁矿硫、伴生硫铁矿硫和自然硫构成。而自然硫因采选技术尚处于试验阶段,短期内还难以开发利用。所以硫铁矿和伴生硫铁矿是中国当前以后相当一段时期的主要硫源。
分辨方式
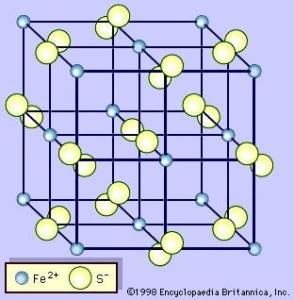 二硫化铁立方晶型
二硫化铁立方晶型
应用领域
硫酸工业
在橡胶、造纸、纺织、食品、火柴等工业以及农业中均有重要用途。特别是国防工业上用以制造各种炸药、发烟剂等。以硫铁矿为原料制取硫酸,其矿渣可用来炼铁、炼钢。若炉渣含硫量较高,含铁量不高时,可以用作水泥的附属原料——混合料。
上游原料:柴油、工业导火索、雷管、煤、汽油、水泥、炸药
下游产品:硫酸、氯磺酸、硫酸锰、二氧化硫、硫磺、铁粉、过磷酸钙、酚醛树脂漆类、氨合成催化剂
金属冶炼工业
硫化铁矿这种主要成分为FeS2的矿石,含铁量为46.6 %,而硫的含量达到53.4 %,呈现灰黄色,比重约为4.95~5.10。同时这种矿石常常含有许多其它较贵重的金属,如铜、镍、锌、金、银等;同时,硫铁矿又常与铜、铅、锌、钼等硫化矿床共生,并含有金、钴、钼及稀有元素硒等,能综合回收利用。所以常被用做金属冶炼工业的原料。
工业上常利用黄铁矿制硫酸工艺的残渣作为钢铁冶金原料使用。残渣主要化学成分为Fe2O3,一般含铁40 %~55 %,含硫1.5 %~2.0 %,硫酸渣作为金属冶炼的原料,主要是利用其中含铁成分,降低烧结原料的生产成本。烧结料中硫酸渣的陪加量一般在10 %以下。将硫酸渣进行处理,增加细度,提高其含铁量,降低含硫量,可作为球团矿的原料。
光电材料
黄铁矿(pyrite)二硫化亚铁是一种在自然界储量非常丰富的无毒环境友好型间接带隙半导体材料,带隙宽度为0.95 eV。非常接近理想太阳能电池材料所需要的1.1 eV的要求,同时具有优良的光吸收能力,吸收系数达到105 cm-1。因此二硫化亚铁材料是一种非常具有潜力的新型光伏材料。2009年相关文献报道中,其在23种材料中居榜首成为最有潜力的代硅高效低价太阳电池材料。
FeS2具有合适的禁带宽度,较高的光吸收系数,可制作极薄(<200 nm)的太阳能薄膜电池,价格便宜资源丰富,无毒,具有很好的环境相容性,适合大规模生产,被认为是一种极具发展潜力的太阳能电极材料。所以商业电池的正极材料都采用天然的FeS2,但是天然FeS2由于杂质含量高、粒径大等问题,其产品实际电化学性能与其理论值相差甚远,需要进一步处理以提高其放电性能。
而人工合成的 FeS2由于纯度高,粒径小,晶粒粒径的减小增强了Li嵌入FeS2形成LixFeS2的动力学特征,因此合成的FeS2正极具有更高的比容量,其电化学性能要优于天然 FeS2,所以越来越多的科研工作者致力于合成 FeS2的研究。
(1) 天然FeS2的改性
将天然FeS2在氮气中加热后再用酸洗。实验结果表明,经过改性处理后的FeS2中金属氧化物和金属硫化物杂质的含量明显减少,并且处理后的FeS2的晶粒尺寸也要小于天然FeS2。晶粒小和纯度高是Li/改性FeS2电池放电容量显著增加的主要原因。
在有添加剂PZ 的条件下,用间歇式搅拌磨可制备粒度小于310μm的黄铁矿超细粉体,最佳超细粉体制备工艺是:球料比为5:1,矿浆浓度为50 %,磨矿时间为4 h,给料粒度应尽可能小。但是黄铁矿在超细粉磨过程中极易发生氧化,这是选矿行业中长期以来难以解决的问题。
在正极材料中加入金属单质和氧化物以及增加电解液中无机盐的含量,使Li/FeS2电池的放电容量和放电平台都有显著改善。制造电池时最好采用复合添加剂,使电池在不同的放电制度下都有良好的性能,但主要考虑在重负载条件下的性能。最佳的生产条件为金属0.5 %、氧化物3 %、无机盐0.4 %。
通过在还原的FeS2正极材料微粒表面包覆一层很薄的离子导电保护膜(SEI膜)可以为全充电或全放电状态下的正极活性物质提供保护,从而改善电池的电化学性能。包覆了SEI膜的正极活性物质装配的电池在500次100 %放电循环中每个循环的容量衰减小于0.1 %。
用明胶/二甲基亚砜溶液对天然 FeS2进行改性处理,取得了不错的效果。FeS2正极材料的可逆比容量显著增加可能归因于明胶对FeS2晶粒的包覆,从而有效地减弱了在Li嵌入和脱出过程中电解液对正极材料的溶解作用。
(2) 合成FeS2的研究
电化学沉积法合成FeS2:电化学沉积法工艺简单,成本低,容易大面积成膜,具有重要的研究价值。电化学沉积法制备FeS2薄膜与基片选择、硫化温度、硫化时间、硫化压力等影响因素密切相关。
水热法合成FeS2:水热法是在特制的密闭反应容器(高压釜)里,采用溶液为反应介质,通过对反应容器加热,创造一个高温、高压的反应环境,使得通常难溶或不溶的物质溶解并且重结晶。在制备过程中S原子的引入有利于增加成核数目,提高FeS2微晶的结晶度;对于特定的水热反应体系,随着反应温度的升高合成的FeS2粉体颗粒直径将增大;在一定范围内,反应时间对粉体粒径的影响呈线性。
溶剂热法合成FeS2:溶剂热法就是在水热法的基础上,于特定的密闭反应器(高压釜)中,采用有机溶剂作为反应体系,通过将反应体系加热至一定温度,在反应体系中产生高压环境而进行无机合成与材料制备的一种有效的方法。反应时间和反应温度是控制晶粒物相、线度及结晶完整性的重要参数;溶液的pH值则是影响晶粒粒度以及样品分散性的重要参数;保护剂兼分散剂 PVP的加入,更有效地减少了团聚的形成。
机械球磨法合成 FeS2:在高能球磨过程中加入固态分散剂NaCl,得到了高分散的纳米级FeS2晶粒。此外,固态分散剂NaCl的存在还促进了晶粒的形成和生长。
现阶段人工合成FeS2的成本是阻碍其工业化的主要问题之一,而水热法及溶剂法合成的FeS2由于其类似于天然FeS2矿石合成条件的独特优势,且工艺简单,合成条件温和,得到越来越多的关注。另一方面,FeS2具有优良的高温电化学性能,因此Li/FeS2热电池成为电动汽车最有吸引力的高能动力来源之一。
毒理危害
危害:通常来说对水是无害的,若无政府许可,勿将材料排入周围环境
安全术语:S26;S36;S37;S39
风险术语:S32;S36;S37;S38
危险品运输编号:UN3178
危险类别:4.1
包装等级:III
危险品标志:易燃、刺激
安全性描述
主要的刺激性影响
在皮肤上面:刺激皮肤和粘膜
在眼睛上面:刺激的影响
致敏作用:没有已知的敏化现象
储存条件
常温密闭,阴凉通风干燥。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













