-
氨水
 氨水
氨水
氨水,又称阿摩尼亚水,是氨的水溶液,主要成分为NH3·H2O,由氨气通入水中制得。
氨水是实验室的重要试剂,主要用作分析试剂、中和剂、生物碱浸出剂、铝盐合成和弱碱性溶剂,也用于某些元素(如铜、镍)的检定和测定。
目录
- 1 基本信息
2 组成成分
3 物化性质
4 主要用途
5 注意事项
6 毒理学数据
7 现状发展
8 常见谣言
基本信息
中文名:氨水
别称:阿摩尼亚水
分子量:35.045
EINECS登录:215-647-6
沸点:37.7°C (25%)24.7°C(32%)
密度:0.91 g/cm³ (25 %)0.88 g/cm³(32 %)
应用:化学领域
危险性符号:对环境有害
危险品运输编号:UN 2672 8/PG 3
爆炸极限:25%—29%
H·S编码:2814200010
英文名:ammonium hydroxide
化学式:NH₃·H₂0
CAS登录号:1336-21-6
熔点:-77℃
水溶性:易溶
外观:无色透明液体
安全性描述:S26 S45 S61 S36/S37/S39
危险性描述:R34 R50
饱和蒸气压:1.59kPa(20℃)
危险等级:8
组成成分

分子:NH3、H2O、NH3·H2O
离子:NH4+,OH-和H+
其中 H2O(多)NH3(较少)NH4+(少) OH-(少) H+(很少) NH3·H2O(较多)
物化性质
 氨水
氨水
腐蚀性
氨水有一定的腐蚀作用,碳化氨水的腐蚀性更加严重。对铜的腐蚀比较强,钢铁比较差,对水泥腐蚀不大。对木材也有一定腐蚀作用。属于危险化学品,危规号82503。
弱碱性
氨水中存在以下化学平衡:
NH3+H2O⇌NH3·H2O
NH3·H2O⇌NH4++OHˉ(可逆反应)电离常数:K=1.8×10-5(25℃)
因此仅有一小部分氨分子与水反应而成铵离子NH4+和氢氧根离子OH-,故呈弱碱性。
氨水具有碱的通性:
①能使无色酚酞试液变红色,能使紫色石蕊试液变蓝色,能使湿润红色石蕊试纸变蓝。实验室中常用此法检验NH3的存在。
②能与酸反应,生成铵盐。浓氨水与挥发性酸(如浓盐酸和浓硝酸)相遇会产生白烟。
NH3+HCl=NH4Cl(白烟)
NH3+HNO3=NH4NO3(白烟)
而遇不挥发性酸(如硫酸、磷酸)无此现象。因此实验室中可用此法检验水中氨分子的存在。
工业上,利用氨水的弱碱性来吸收硫酸工业尾气,防止污染环境。
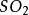
不稳定性
一水合氨不稳定,受热易分解而生成氨和水。
NH3·H2O=△=NH3↑+H2O
实验室中,可用加热浓氨水制氨或常温下用浓氨水与固体烧碱混合的方法制氨气,其装置与操作简便,且所得到的氨气浓度较大,做“喷泉”实验效果更佳。
由于氨水具有挥发性和不稳定性,故氨水应密封保存在棕色或深色试剂瓶中,放在冷暗处。
可燃性
可以和氧气反应生成水和氮气,故有前景做无害燃料。但是缺点是必须在纯氧气中燃烧。(燃烧现象:氨气在纯氧中燃烧,放出红光,发热,生成无色气体和无色液滴)
沉淀性
氨水是很好的沉淀剂,它能与多种金属离子反应,生成难溶性弱碱或两性氢氧化物。例如:
Al3++3NH3·H2O Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
生成的Al(OH)3沉淀难溶于过量氨水。
Fe2﹢2NH3·H2O=Fe(OH)2↓+2NH4+
生成的白色沉淀易被氧化生成红褐色沉淀
4Fe(OH)2+O2+2H2O=4Fe(OH)3
利用此性质,实验中可制取Al(OH)3、Fe(OH)3、Fe(OH)2(苯层覆盖)等。
络合性
氨水与Ag+、Cu2+、Cr3+、Zn2+等离子能发生络合反应,当氨水少量时,产生不溶性弱碱,当氨水过量时,不溶性物质又转化成络离子而溶解。
Ag2O+4NH3·H2O 2﹢ +2OHˉ+3H2O 实验室中用此反应配制银氨溶液。
2﹢ +2OHˉ+3H2O 实验室中用此反应配制银氨溶液。
Zn(OH)2+4NH3·H2O 2﹢+2OHˉ+4H2O
2﹢+2OHˉ+4H2O
可用此反应来鉴别两性氢氧化物氢氧化铝和氢氧化锌。
Cu(OH)2+4NH3·H2O 2+(深蓝色) +2OHˉ+4H2O
2+(深蓝色) +2OHˉ+4H2O
还原性
氨水表现出弱的还原性,可被强氧化剂氧化。如氨水可与氯水发生反应:
3Cl2+8NH3·H2O =6NH4Cl+N2+8H2O
=6NH4Cl+N2+8H2O
也可与KMnO4反应。
氧化性
氨分子中+1氧化态的氢则表现出弱氧化性,可将强还原剂氧化。如液氨把碱金属氧化:
2NH3+ 2Na = 2NaNH 2+ H2↑
2+ H2↑
主要用途
实验室用途
氨水是实验室重要的试剂,主要用作分析试剂,中和剂,生物碱浸出剂,铝盐合成和弱碱性溶剂。用于铝盐合成和某些元素(如铜、镍)的检定和测定,用以沉淀出各种元素的氢氧化物。
军事用途
作为一种碱性消毒剂,用于消毒沙林类毒剂。常用的是10%浓度的稀氨水(密度0.960),冬季使用浓度则为20%。
工业用途
毛纺、丝绸、印染等工业用于洗涤羊毛、呢绒、坯布,溶解和调整酸碱度,并作为助染剂等。 有机工业用作胺化剂,生产热固性酚醛树脂的催化剂,无机工业用于制选各种铁盐。
工业上用于大规模集成电路减压或等离子体CVD,以生长二氧化硅膜锅炉给水pH值调节剂,氨用来中和给水中的碳酸,提高pH值,减缓给水中二氧化碳的腐蚀。也是锅炉停炉保护剂,对锅炉内有少量存水不能放出的锅炉也有较好的保护效果。
5.医药上用稀氨水对呼吸和循环起反射性刺激,医治晕倒和昏厥,并作皮肤刺激药和消毒药。
6.作洗涤剂、中和剂、生物碱浸出剂。还用于制药工业,纱罩业,晒图等。
农业用途
农业上经稀释后可做化肥
农用氨水的氨浓度一般控制在含氮量15%~18%的范围内,碳化度最好大于100%。施肥简便,方法也较多,如沟施、面施、随着灌溉水施或喷洒施用。使用时须先用水稀释至千分之一以下,切忌同茎叶接触以免灼伤。
氨水的施用原则是“一不离土,二不离水”。不离土就是要深施覆土;不离水就是加水稀释以降低浓度、减少挥发,或结合灌溉施用。由于氨水比水密度小,灌溉时要注意避免局部地区积累过多而灼伤植株。氨水可作基肥也可作追肥。
我国常用的农用氨水浓度为含氨15%、17%和20%三种,国外农用氨水的浓度稍高,一般为含氨25%(含氮20%)的产品。我国2008年氨水的产量不到氮肥总产量的0.2%。
注意事项
危险性概述
侵入途径:吸入、食入
健康危害:吸入后对鼻、喉和肺有刺激性,引起咳嗽、气短和哮喘等;可因喉头水肿而窒息死亡;可发生肺水肿,引起死亡。氨水溅入眼内,可造成严重损害,甚至导致失明,皮肤接触可致灼伤。慢性影响:反复低浓度接触,可引起支气管炎。皮肤反复接触,可致皮炎,表现为皮肤干燥、痒、发红。如果身体皮肤有伤口一定要避免接触伤口以防感染。
急救措施
皮肤接触:立即用水冲洗至少15分钟。若有灼伤,就医治疗。对少量皮肤接触,避免将物质播散面积扩大。注意患者保暖并且保持安静。
眼睛接触:立即提起眼睑,用流动清水或生理盐水冲洗至少15分钟。或用3%硼酸溶液冲洗。立即就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。呼吸困难时给输氧。呼吸停止时,立即进行人工呼吸。就医。如果患者食入或吸入该物质不要用口对口进行人工呼吸,可用单向阀小型呼吸器或其他适当的医疗呼吸器。脱去并隔离被污染的衣服和鞋。
食入:误服者立即漱口,口服稀释的醋或柠檬汁,就医。吸入、食入或皮肤接触该物质可引起迟发反应。确保医务人员了解该物质相关的个体防护知识,注意自身防护。
消防措施
危险特性:易分解放出氨气,温度越高,分解速度越快,可形成爆炸性气氛。若遇高热,容器内压增大,有开裂和爆炸的危险。与强氧化剂和酸剧烈反应。与卤素、氧化汞、氧化银接触会形成对震动敏感的化合物。接触下列物质能引发燃烧和爆炸:三甲胺、氨基化合物、1-氯-2,4-二硝基苯、邻—氯代硝基苯、铂、二氟化三氧、二氧二氟化铯、卤代硼、汞、碘、溴、次氯酸盐、氯漂、有机酸酐、异氰酸酯、乙酸乙烯酯、烯基氧化物、环氧氯丙烷、醛类。腐蚀某些涂料、塑料和橡胶。腐蚀铜、铝、铁、锡、锌及其合金。
灭火方法:雾状水、二氧化碳、砂土。
泄漏应急处理
应急处理:疏散泄漏污染区人员至安全区,禁止无关人员进入污染区,建议应急处理人员戴自给式呼吸器,穿化学防护服。不要直接接触泄漏物,在确保安全情况下堵漏。用大量水冲洗,经稀释的洗水放入废水系统。也可以用沙土、蛭石或其它惰性材料吸收,然后以少量加入大量水中,调节至中性,再放入废水系统。如大量泄漏,利用围堤收容,然后收集、转移、回收或无害处理后废弃。
操作处置
储存注意事项:储存于阴凉、干燥、通风处。远离火种、热源。防止阳光直射。保持容器密封。应与酸类、金属粉末等分开存放。露天贮罐夏季要有降温措施。分装和搬运作业要注意个人防护。搬运时要轻装轻卸,防止包装及容器损坏。运输按规定路线行驶,勿在居民区和人口稠密区停留。
毒理学数据
1、急性毒性:
人体口经LDLo:43mg/kg;人体吸入LCLo:5000ppm;人体吸入TCLo:408ppm;小鼠口经LD50:350mg/kg;小鼠皮下LDLo:160mg/kg;小鼠静脉LD50:91mg/kg;小猫口经LDLo:750mg/kg;小兔皮下LDLo:200mg/kg;大鼠经口LD50:350mg/kg。
2.急性毒性 LD50:350mg/kg(大鼠经口)
3.刺激性
家兔经皮:250μg,重度刺激。
家兔经眼:44μg,重度刺激。
现状发展
1,氨水行业生命周期。通过对氨水行业的市场增长率、需求增长率、产品品种、竞争者数量、进入壁垒及退出壁垒、技术变革、用户购买行为等研判行业所处的发展阶段;
2,氨水行业市场供需平衡。通过对氨水行业的供给状况、需求状况以及进出口状况研判行业的供需平衡状况,以期掌握行业市场饱和程度;
3,氨水行业竞争格局。通过对氨水行业的供应商的讨价还价能力、购买者的讨价还价能力、潜在竞争者进入的能力、替代品的替代能力、行业内竞争者的竞争能力的分析,掌握决定行业利润水平的五种力量;
4,氨水行业经济运行。主要为数据分析,包括氨水行业的竞争企业个数、从业人数、工业总产值、销售产值、出口值、产成品、销售收入、利润总额、资产、负债、行业成长能力、盈利能力、偿债能力、运营能力。
5,氨水行业市场竞争主体企业。包括企业的产品、业务状况(BCG)、财务状况、竞争策略、市场份额、竞争力(SWOT分析)分析等。
6,投融资及并购分析。包括投融资项目分析、并购分析、投资区域、投资回报、投资结构等。
7,氨水行业市场营销。包括营销理念、营销模式、营销策略、渠道结构、产品策略等。
常见谣言
谣言:2NH3+3H2O2=N2+6H2O
驳斥:这是以偏概全,事实上过氧化氢与氨水的反应比较复杂,除了形成氮气的反应外还可以得到肼或者羟胺。
生成肼的反应:
实验结果表明,在微波作用下,以磷酸二氢铵或磷酸二氢钾为催化剂、乙腈为助催化剂,用低浓度过氧化氢氧化氨可以得到浓度为5.1%的水合肼。
生成羟胺的反应:
(丁酮氨氧化)肟化反应机理为羟胺路线,即先由H2O2和NH3在TS-1催化作用下生成羟胺,生成的羟胺与丁酮进行肟化反应生成丁酮肟。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













