-
硫酸铝
 硫酸铝
硫酸铝
硫酸铝(化学式Al2(SO4)3,式量342.15)是一种无味、有光泽的白色斜方晶系结晶粉末,密度1.69g/mL(25℃)。
在造纸工业中作为松香胶、蜡乳液等胶料的沉淀剂,水处理中作絮凝剂,还可作泡沫灭火器的内留剂,制造明矾、铝白的原料,石油脱色、脱臭剂、某些药物的原料等。还可制造人造宝石及高级铵明矾。
大约占总产量50%的硫酸铝第一大用途是用于造纸,第二大用途是在饮用水、工业用水和工业废水处理中做絮凝剂,大约占硫酸铝总产量40%。当向这类水中加入硫酸铝后,可以生成胶状的、能吸附和沉淀出细菌、胶体和其他悬浮物的氢氧化铝絮片,用在饮用水处理中可控制水的颜色和味道。
目录
- 1 基本信息
2 研究简史
3 理化性质
4 分布情况
5 制备方法
6 应用领域
7 毒理危害
8 储存运输
9 检测方法
基本信息
危险性描述:R36/37/38;R41;R51/53
别称:硫酸铝(3:2);明矾,硫酸铝
分子量:342.15
危险品运输编号:UN 1760/3077
熔点:770 °C (dec.)(lit.)
密度:2.71 g/mL at 25 °C(lit.)
应用:用于人造宝石和高级铵明矾的生产
中文名:硫酸铝
英文名:Aluminium sulfate
化学式:Al2(SO4)3
CAS登录号:10043-01-3
EINECS登录:233-135-0
水溶性:soluble
外观:无味、白色结晶性粉末、吸湿、有光泽的晶体或粉末
危险性符号:Xi
安全性描述:S26;S29;S37/39;S61
研究简史
古代,人们曾用一种称为明矾(意思是结合)的矿物作染色固定剂。俄罗斯第一次生产明矾的年代可追溯到八至九世纪。明矾用于染色业和用山羊皮鞣制皮革。
中世纪,在欧洲有好几家生产明矾的作坊。
16世纪,德国医生兼自然科学历史学家帕拉塞斯(Parace/sus PAT1949-1541)在铝的历史上写下了新的一页。他研究了许多物质和金属,其中也包括明矾(硫酸铝),证实它们是"某种矾土盐"。这种矾土盐的一种成份是当时还不知道的一种金属氧化物,后来叫做氧化铝。
1745年,德国化学家马格拉夫终于能够分离“矾土“了。这正是帕拉塞提到过的那种物质。
理化性质
外观与性状:白色晶体,有甜味;
溶解性:溶于水,不溶于乙醇等。
工业品为灰白色片状、粒状或块状,因含低铁盐带淡绿色,又因低价铁盐被氧化而使表面发黄。粗品为灰白色细晶结构多孔状物。
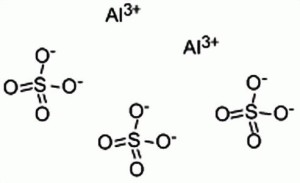 硫酸铝化学结构式
硫酸铝化学结构式
770℃分解为氧化铝和三氧化硫。
有无水物和十八水合物。无水物为无色斜方晶系晶体。溶于水,水溶液显酸性,微溶于乙醇。在水中的溶解度随温度的上升而增加。十八水合物(Al2·(SO4)3·18H2O)为无色单斜晶体。溶于水,不溶于乙醇。水溶液因水解而呈酸性。
相对密度(水=1):2.71
不同温度(℃)时每100毫升水中的溶解克数:
| 31.2g/0℃ |
| 33.5g/10℃ |
| 36.4g/20℃ |
| 40.4g/30℃ |
| 45.8g/40℃ |
| 59.2g/60℃ |
| 73g/80℃ |
| 80.8g/90℃ |
| 89g/100℃ |
水中溶解度:
| 温度(℃) | 溶解度(g) |
| 0 | 31.2 |
| 10 | 33.5 |
| 20 | 36.5 |
| 30 | 40.4 |
| 40 | 45.7 |
| 50 | 52.2 |
| 60 | 59.2 |
| 70 | 66.2 |
| 80 | 73.1 |
| 90 | 86.8 |
| 100 | 89.0 |
化学性质
不易风化而失去结晶水,比较稳定,加热会失水,高温会分解为氧化铝和硫的氧化物。
加热至770℃开始分解为氧化铝、三氧化硫、二氧化硫和水蒸气。溶于水、酸和碱,不溶于乙醇。水溶液呈酸性。水解后生成氢氧化铝。水溶液长时间沸腾可生成碱式硫酸铝。无毒,粉尘能刺激眼睛。
水解产物有碱式盐和氢氧化铝的胶状沉淀。容易跟钾、钠、铵的盐结合形成矾,如硫酸铝钾
kAl(SO4)2·12H2O。
加热水合物时,猛烈膨胀,并变成海绵状物,加热至赤热时,分解为三氧化硫和氧化铝。
毒性:
ADI 未规定(FAO/WHO,2001)。
GRAS(FDA,§182.1125,2000)。
LD50:980±90 mg/kg(小鼠经口)
计算化学数据
1、疏水参数计算参考值(XlogP):未确定
2、氢键供体数量:0
3、氢键受体数量:8
4、可旋转化学键数量:0
5、拓扑分子极性表面积(TPSA):161
6、重原子数量:12
7、表面电荷:0
8、复杂度:62.2
9、同位素原子数量:0
10、确定原子立构中心数量:0
11、不确定原子立构中心数量:0
12、确定化学键立构中心数量:0
13、不确定化学键立构中心数量:0
14、共价键单元数量:4
分布情况
明矾石,一种分布广的造岩的硫酸盐矿物,其含量超过K时称钠矾石或钠明矾石,有时也有少量Fe3+代替Al3+。在火山岩例如流纹岩、粗面岩和安山岩内呈囊状体或薄层产出,据认为它是由于这些岩石与逸出的含硫蒸气进行化学反应形成的。 明矾石为中酸性火山喷出岩经过低温热液作用生成的蚀变产物。中国浙江苍南、安徽庐山和福建福鼎的白垩系火山岩中都有大量产出。大的矿床在乌克兰的别烈戈沃(Beregovo)附近、西班牙的阿尔梅利亚(Almeria)和澳大利亚新南威尔士的布拉德拉(Bullah Delah)。
明矾石矿是浙江省的重要优势矿种之一。探明资源储量占全国总量的53%,居中国之首,主要分布在苍南、平阳、瑞安三县市,萧山、鄞县也有矿产地。
浙江省已探明资源储量矿产地10处,其中苍南矾山的鸡笼山、水尾山,瑞安仙岩和萧山岩山等4处为大型矿床;苍南矾山的大岗山、瑞安平阳坑、鄞县凤凰山等3处为中型矿床。明矾石保有资源储量9104万吨(矿石量约2.25亿吨)。
制备方法
由铝土矿和硫酸加压反应制得。或用硫酸分解明矾石、高岭土及含氧化铝硅原料均可制得。
硫酸法将铝土矿粉碎至一定粒度,加人反应釜与硫酸反应,反应液经沉降,澄清液加入硫酸中和至中性或微碱性,然后浓缩至115℃左右,经冷却固化,粉碎制得成品。
化学反应方程式: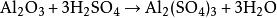
1.硫酸法:将铝土矿粉碎至一定粒度.应釜与硫酸反应。由氢氧化铝(或纯的高岭土或铝矾土)与硫酸反应后,滤去不溶物再结晶而得。
2.将从酸性溶液中结晶生成的水合硫酸铝晶体缓慢加热,使其逐步脱水,最后将温度升高到350℃,则完全脱水成为无水硫酸铝。
应用领域
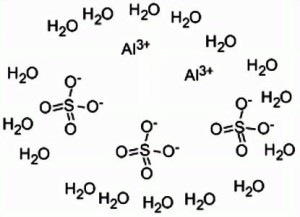 硫酸铝化学结构式
硫酸铝化学结构式
造纸工业中作为松香胶、蜡乳液等胶料的沉淀剂,水处理中作絮凝剂,还可作泡沫灭火器的内留剂,制造明矾、铝白的原料,石油脱色、脱臭剂、某些药物的原料等。还可制造人造宝石及高级铵明矾。砷含量不大于5mg/kg的产品可用于水处理絮凝剂。
1.造纸工业中用作纸张施胶剂,以增强纸张的抗水、防渗性能;
2.溶于水后能使水中的细小微粒和自然胶粒凝聚成大块絮状物,从而自水中除去,故用作供水和废水的混凝剂;
3.用作浊水净化剂,也用作沉淀剂、固色剂、填充剂等。在化妆品中用作抑汗化妆品原料(收敛剂);
4.消防工业中,与小苏打、发泡剂组成泡沫灭火剂;
5.分析试剂,媒染剂,鞣革剂,油脂脱色剂,木材防腐剂;
6.白蛋白巴氏杀菌的稳定剂(包括液体或冷冻全蛋、蛋白或蛋黄);
7.可作原料,用于制造人造宝石和高级铵明矾,其他铝酸盐;
8.燃料工业中,在生产铬黄和色淀染料时作沉淀剂,同时又起固色和填充剂作用。
淋洗对硫酸铝改良苏打盐碱土的辅助效果研究:该研究以松嫩平原中前郭地区中重度盐碱土为研究对象,采用实验室模拟分析的形式,添加硫酸铝改良后,再进行淋洗的效果进行了分析。分别选择硫酸铝的添加浓度为0%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%进行测定,研究了这七种情况在分别淋洗一次、两次、三次后,土壤溶液中的主要离子浓度和变化趋势,并对这七种浓度添加后的物理性质进行了测定。综合各项试验结果,得出以下结论。
淋洗有效改善了土壤的盐化度。在硫酸铝添加量一定的情况下,随着淋洗次数的增加,硫酸根离子和氯离子等阴离子的浓度明显下降。碳酸根和碳酸氢根也有明显下降,但受空气中二氧化碳的影响,下降速度并没有硫酸根和氯离子快,但也明显改善了土壤的离子结果,使土壤更适合作物生长。
淋洗有明显的改善土壤化学成分的作用,但是添加入的硫酸铝随着淋洗也有大量的流逝,同时在震荡等作用下,第一次投入硫酸铝形成的部分硫酸铝水解胶体也被破坏,影响了硫酸铝对土壤的改良效果。同时,淋洗震荡过程也破坏了土壤中原有的团聚体和微团聚体,多次淋洗使土壤的物理性质没有改善,甚至在土壤溶液pH值方面产生负面效果。
当不淋洗土壤时,硫酸铝的加入,有效改善了土壤性质,特别是对降低土壤碱化度,效果明显。土壤pH值、土壤容重、土壤颗粒粒径等方面对土壤都有改善作用,并且效果明显。钙镁等离子也随着硫酸铝的添加而被释放出来,从一定程度上也起到了降低土壤盐化度的作用。但单独使用硫酸铝改良,并不能全面的解决松嫩平原的土壤问题。由于土壤还有较高的盐化度,硫酸铝并没有有效改善土壤的盐化度问题,甚至添加硫酸铝时土壤中盐类物质的含量增加。因此,硫酸铝只是将土壤类型从苏打型转化为硫酸型,问题被缓解,但是并未完全解决。
综合硫酸铝和淋洗这两种改良方法的利弊,将两种改良方式相结合,得到既可以改善土壤的碱化度问题,也可以改善土壤的盐化度问题,更好的改善土壤环境。在添加硫酸铝为0.8%时,淋洗土壤两次,研究人员指出可以取得最好的改善效果。
9、用作动物胶的有效交联剂,并能提高动物胶的黏度。还用作脲醛胶黏剂的固化剂,20%水溶液固化速度较快。
毒理危害
小鼠经口LC50:6207mg/kg。
生态学资料
通常对水体是稍微有害的,不要将未稀释或大量产品接触地下水,水道或污水系统,未经政府许可勿将材料排入周围环境。
环境危害
燃爆危险:该品不燃,具刺激性。
健康危害
对眼睛、粘膜有一定的刺激作用。误服大量硫酸铝对口腔和胃产生刺激作用。
皮肤接触:脱去污染的衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入:脱离现场至空气新鲜处。如呼吸困难,给输氧。就医。
食入:饮足量温水,催吐。就医。
危险特性:未有特殊的燃烧爆炸特性。受高热分解产生有毒的硫化物烟气。
有害燃烧产物:自然分解产物未知。
防治手段
灭火方法:消防人员必须穿全身防火防毒服,在上风向灭火。灭火时尽可能将容器从火场移至空旷处。
应急处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘面具(全面罩),穿防毒服。用洁净的铲子收集于干燥、洁净、有盖的容器中,转移至安全场所。若大量泄漏,收集回收或运至废物处理场所处置。
操作注意事项:密闭操作,局部排风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。避免产生粉尘。避免与氧化剂接触。搬运时轻装轻卸,防止包装破损。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存运输
储存注意事项:储存于阴凉、通风的库房。远离火种、热源。应与氧化剂分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
储运:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与氧化剂、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。车辆运输完毕应进行彻底清扫。
检测方法
配10%试样液,其铝盐(IT-2)和硫酸盐(IT-29)试验应呈阳性。溶解性极易溶于水,不溶于乙醇。按OT-42方法测定。5%水溶液的pH值2.9或以上,用玻璃电极测定。
含量分析:精确称取试样约4g,放入250ml容量瓶中,用水溶解并定容后混合。吸取该溶液10ml,放入250ml烧杯,加0.05mol/L的EDTA二钠(乙二胺四乙酸二钠)溶液25.0ml和pH 4.5的缓冲液(由77.1g醋酸铵和57ml冰醋酸加水定容至1000ml)20ml,文火煮沸5min。冷却后,加乙醇.50ml和双硫腙试液(TS-94)2ml。用0.05mol/L硫酸锌液滴定至鲜明的玫红色,同时进行空白滴定。每毫升0.05mol/L的EDTA二钠(乙二胺四乙酸二钠)相当于硫酸铝Al2(SO4)3的8.554mg或含水硫酸铝16.66mg。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













