-
硫酸铜
 硫酸铜
硫酸铜
硫酸铜(英文名:cupric sulfate)是一种无机化合物,化学式CuSO4。为白色或灰白色粉末,水溶液呈弱酸性,显蓝色。
从水溶液中结晶时,生成蓝色的五水硫酸铜(CuSO4·5H2O,又称胆矾),此原理可用于检验水的存在。受热失去结晶水后分解,在常温常压下很稳定,不潮解,在干燥空气中会逐渐风化。
硫酸铜是制备其他含铜化合物的重要原料,既是一种肥料,又是一种普遍应用的杀菌剂。波尔多液、铜皂液、铜铵制剂,就是用硫酸铜与石灰乳、肥皂、碳酸氢铵配制而成的。
目录
- 1 基本信息
2 理化性质
3 制备方法
4 应用领域
5 毒理危害
6 储存运输
7 检测方法
8 环境标准
基本信息
中文名:硫酸铜
分子量:159.61
EINECS登录:231-847-6
水溶性:溶于水
外观:白色或灰白色结晶
蒸汽压:7.3mmHg
安全性描述:S24/25;S36;S60;S61;S22
危险性描述:Xn;N
化学式:CuSO₄
CAS登录号:7758-98-7
熔点:560℃
密度:3.606(g/mL 25ºC)
类别:无机化合物
特点:水溶液呈弱酸性、显蓝色
危险性符号:R22;R36/38;R50/53
外文名:cupric sulfate
理化性质
无水硫酸铜
 无水硫酸铜粉末
无水硫酸铜粉末
熔点:560℃。
密度:3.606g/mL (25ºC)
蒸气压:7.3mm Hg(25ºC)
溶解性:溶于水、甲醇。不溶于乙醇
五水硫酸铜
五水硫酸铜理化性质为透明的深蓝色结晶或粉末,在0℃水中的溶解度为316克/升,不溶于乙醇,几乎不溶于其他大多数有机溶剂。在甘油中呈宝石绿色,空气中缓慢风化,加热失去两分子结晶水(30℃),在110℃下失水变成白色水合物(CuS04・H20)。含杂质多时呈黄色或绿色,无气味。本品对铁有很强的腐蚀性。硫酸铜既是一种肥料,又是一种普遍应用的杀菌剂。波尔多液、铜皂液、铜铵制剂,就是用硫酸铜与生石灰、肥皂、碳酸氢铵配制而成的。
化学性质
1.极易吸收空气中的水汽而变成水合物。加热后失去结晶水,加热到102℃失去两个结晶水;113℃失去三个结晶水;258℃失去全部结晶水;当加热温度达653℃时,开始分解生成CuO和SO3,在720℃时分解结束。
生成结晶水的变化如下:
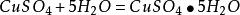
在不同的温度下发生的变化如下:
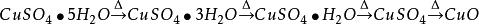
2.与活动顺序位于铜以前的单质发生置换反应,如铁、锌,但不能与过于活泼的金属(如钠、钾等)置换。
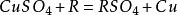
3.与碱反应
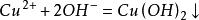
与氨水反应,少量时生成氢氧化铜,过量时生成配合物硫酸四氨合铜。
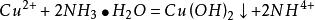
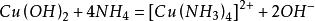
现象:向硫酸铜溶液中加入少量氨水,有蓝色沉淀生成;继续加入氨水,沉淀溶解,生成深蓝色溶液。加入乙醇,有深蓝色沉淀析出。
4.与盐的反应
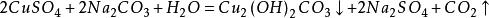
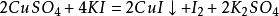
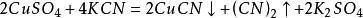
5.电化学反应
在中学和普通化学教育中,硫酸铜被用作原电池的电解液,通常作为阳极溶液。例如,在铜—锌原电池中,硫酸铜溶液中的铜离子从锌中吸收电子,形成金属铜。
锌片反应: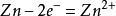
铜片反应: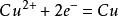
总反应: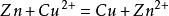
制备方法
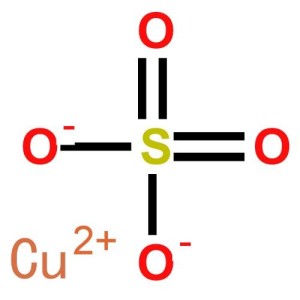 硫酸铜结构式
硫酸铜结构式
一种方法是将硫酸与铜混合加热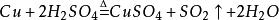
此方法由于会产生有害气体二氧化硫,因此实际应用较少
另一种方法是将铜粉在600~700℃下进行焙烧,氧化成为氧化铜,再经硫酸分解、澄清除去不溶杂质,经冷却结晶、过滤、干燥,制得硫酸铜成品;
反应式如下:
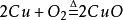
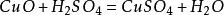
2.电解液回收法
废电解液(含Cu50~60g/L,H2SO4180~200g/L)与经焙烧处理的铜泥制成细铜粉进行反应,反应液分离沉降后清液经冷却结晶、分离、干燥,制得硫酸铜成品;
3.化学浓缩结晶法
采用低品位氧化铜矿,粉碎至一定粒度,加入硫酸浸渍,加入溶铜沉铁剂,获得铜铁比大于100的硫酸铜溶液,然后加入化学浓缩剂进行浓缩,排走70%~90%的水分,最后经蒸发、冷却结晶、分离、风干,制得硫酸铜成品;
4.将五水合硫酸铜置于瓷皿中,于通风良好处,在砂浴上加热,温度不高于220℃。不断搅动,直至蓝色全部消失为止。将制得的白色粉末研细(如制品呈灰白色证明加热过度)即为无水硫酸铜;
5.回收法
回收氮肥厂合成氨原料气时铜洗塔中醋酸铜氨溶液中的铜化合物沉淀物(习惯上称之为铜污),在700℃焙烧后,经氧化成氧化铜后与硫酸反应生成硫酸铜。
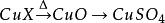
应用领域
用途:
- 用作分析试剂,例如可用于生物学中配置鉴定还原糖的斐林试剂和鉴定蛋白质的双缩脲试剂的B液,但通常是现配现用;
- 用作食品级螯合剂和澄清剂,用于皮蛋和葡萄酒生产工艺中;
- 工业领域。用于制造其他铜盐如氯化亚铜、氯化铜、焦磷酸铜、氧化亚铜、醋酸铜、碳酸铜,铜单偶氮染料如活性艳蓝、活性紫等;涂料工业用于生产船底防污漆;电镀工业用作全光亮酸性镀铜主盐和铜离子添加剂;印染工业用作媒染剂和精染布的助氧剂;有机工业用作合成香料和染料中间体的催化剂,甲基丙烯酸甲酯的阻聚剂。无水盐用于催化转缩醛反应。无水盐与高锰酸钾反应生成一种氧化剂,用于伯醇的转换。
- 农业领域,与石灰水混合后生成波尔多液,作为杀菌剂,用于控制作物上的真菌,防止果实等腐烂;由于铜离子对鱼有毒,用量必须严格控制。养殖业也用作饲料添加剂微量元素铜的主要原料;
- 用于醇类和有机化合物的脱水剂。气体干燥剂。
- 化学教育,硫酸铜通常被包含在儿童的化学实验试剂中,用于晶体的生成试验和电镀铜实验。因为它的毒性,不建议幼儿使用。硫酸铜还可以用来演示晶体失水风化和得到结晶水的过程。 在初中实验考试中,利用硫酸铜与铁发生的置换反应验证质量守恒定律。还可制取硫酸。
- 医疗领域用作催吐剂。
毒理危害
侵入途径:吸入、食入。
健康危害:对胃肠道有刺激作用,误服引起恶心、呕吐、口内有铜性味、胃烧灼感。严重者有腹绞痛、呕血、黑便。可造成严重肾损害和溶血,出现黄疸、贫血、肝大、血红蛋白尿、急性肾功能衰竭和尿毒症。对眼和皮肤有刺激性。长期接触可发生接触性皮炎和鼻、眼粘膜刺激并出现胃肠道症状。
毒理学资料:
毒性:属中等毒性。
急性毒性:LD50:300mg/kg(大鼠经口);33mg/kg(小鼠腹腔)
危险特性:未有特殊的燃烧爆炸特性。受高热分解产生有毒的硫化物烟气。
燃烧(分解)产物:氧化硫、氧化铜。
防治手段
呼吸系统防护:作业工人应该佩戴防尘口罩。
眼睛防护:可采用安全面罩。
防护服:穿工作服。
手防护:必要时戴防护手套。
其它:工作现场禁止吸烟、进食和饮水。工作后,淋浴更衣。注意个人清洁卫生。实行就业前和定期的体检。
泄露处理
隔离泄漏污染区,周围设警告标志。应急人员戴好防毒面具和手套。用大量水冲洗,经稀释的洗液放入废水系统。如大量泄漏,收集回收或无害处理后废弃。
安全标志
S22 不要吸入粉尘。
S60 本物质残余物和容器必须作为危险废物处理。
S61 避免排放到环境中。
危险标志
R22 吞食有害。
R36/38 刺激眼睛和皮肤。
R50/53 对水生生物有极高毒性。
急救措施
皮肤接触:脱去污染的衣着,用大量流动清水彻底冲洗。
眼睛接触:立即翻开上下眼睑,用流动清水或生理盐水冲洗。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。呼吸困难时给输氧。呼吸停止时,立即进行人工呼吸。就医。
食入:误服者用0.1%亚铁氰化钾或硫代硫酸钠洗胃。也可内服大量鸡蛋清以保护冒粘膜及甜茶收敛,并用盐类泻剂,排除肠道内积存的铜制剂农药。体内铜过量时可用络合剂如依地酸二钠钙,每日1克,用50%葡萄糖溶液或生理盐水20~40毫升稀释后静注射。并及时就医。
储存运输
储存于阴凉、干燥、通风良好的库房。远离火种、热源。保持容器密封。应与酸类、碱类、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
运输方法
危险运输编码:UN 3077
危险品标志: 有害,危害环境
包装类别:Z01。
运输注意事项:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与酸类、碱类、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。车辆运输完毕应进行彻底清扫。
检测方法
| 监测方法 | 来源 | 类别 |
|---|---|---|
| 重量法 | GB11899-89 | 水质(硫酸盐) |
| 铬酸钡光度法 | 《水和废水监测分析方法》,国家环保局编 | 水质(硫酸盐) |
| 铬酸钡间接原子吸收法 | 《水和废水监测分析方法》,国家环保局编 | 水质(硫酸盐) |
| EDTA滴定法 | 《水和废水监测分析方法》,国家环保局编 | 水质(硫酸盐) |
| 原子吸收法 | 水质(铜) |
环境标准
| 中国(GB/T14848-93) | 地下水质量标准(mg/L) | I类50;II类150;III类250;IV类350;V类350以上(硫酸盐) |
| 中国(GHZB1-1999) | 地表水环境质量标准(mg/L) | I类250以下;II类250;III类250;IV类250;V类250(硫酸盐) |
| 中国(GB5749-85) | 生活饮用水水质标准 | 250mg/L(硫酸盐) |
| 前苏联(1978) | 渔业水中最高容许浓度 | 4μg/L |
| 前苏联(1975) | 水体中有害物质最高允许浓度 | 0.1mg/L(以铜计) |
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













