-
RNA病毒
 RNA病毒
RNA病毒
RNA病毒是病毒的一种,属于一级。它们的遗传物质是有核糖核酸组成(RNA ribonuclei cacid),通常核酸是单链的(ssRNA single-stranded RNA),也有双链的(dsRNA double-stranded RNA)。单链的RNA病毒根据他们的翻译意义可分为正义、负义和双向翻译的RNA病毒,正义的RNA病毒与mRNA相似,可以直接被宿主细胞翻译成蛋白质;反义RNA病毒则需要借助RNA复制酶的作用,以自身为模板转义出与原病毒相反义的RNA,之后再以此RNA来翻译成蛋白质。
目录
- 1 基本信息
2 基本简介
3 病毒核酸的类型
4 RNA病毒提取方法
5 装配与释放
6 反向遗传学研究
7 RNA病毒族与丙肝病毒
8 双RNA病毒科
9 流感病毒
10 肠道病毒
11 相关信息
基本信息
中文名:RNA病毒
别称:RNA型病毒
等级:一级
常见种类:艾滋病病毒、烟草花叶病毒、SARS 病毒、西班牙流感病毒、甲型H1N1流感病毒
核糖核酸类型:单链RNA、双链RNA
属性:生物病毒
特点:变异很快、病毒疫苗较难开发
外文名:RNA virus
遗传物质:有核糖核酸组成
繁殖方式:复制
科:双RNA病毒科
界:细菌界
直径:80~160nm
类别:专性活细胞内寄生物
基本简介
 RNA病毒
RNA病毒
繁殖方式:复制。
RNA病毒有:艾滋病病毒,烟草花叶病毒,SARS 病毒,西班牙流感病毒,甲型H1N1流感病毒,禽流感病毒,噬菌体(有一部分噬菌体是DNA病毒,如T2噬菌体)等。
病毒核酸的类型
 RNA病毒
RNA病毒
有的病毒核酸并不仅有一个分子,如流感病毒有8条RNA,呼肠孤病毒有11-12条dsRNA。由于病毒种类繁多,核酸类别不同,因而病毒的复制机制不尽相同。
ssRNA病毒的复制
有些ssRNA病毒,一旦病毒颗粒中的RNA进入寄主细胞,就直接作为mRNA,翻译出所编码的蛋白质,其中包括衣壳蛋白和病毒的RNA聚合酶。然后在病毒RNA聚合酶的作用下复制病毒RNA,最后病毒RNA和衣壳蛋白自我装配成成熟的病毒颗粒。这类病毒很多,如ssRNA噬菌体、脊髓灰质炎病毒、鼻病毒、TMV等。
还有另一类ssRNA病毒,它们的复制特点是病毒颗粒中的ssRNA病毒为负链,进入寄主后不能直接作为mRNA,而是先以负链RNA为模板由转录酶转录出与负链RNA互补的RNA,再以这个互补RNA作为mRNA翻译出遗传密码所决定的蛋白质。这类病毒称之为负链非侵染型病毒,如滤泡性口腔炎病毒、流感病毒、副流感病毒、莴苣坏死黄化病毒等。
此外,还有一类特殊的ssRNA病毒即反转录病毒。该类病毒通常引起人和动物的肿瘤,其中包括造成人免疫性缺陷症的艾滋病病毒、白血病病毒、肉瘤病毒等。在它们的髓核中携带反转录酶,能使RNA反向转录成DNA,丰富和发展了分子生物学的中心法则。它们的复制有其特有的特点,一是单链RNA的基因组必须反转录成双链DNA;二是随后这种DNA必须整合到细胞DNA中;三是整合状态长期持续下去并传给子代细胞,也可能转录RNA,生产子代病毒或使细胞转化;四是感染细胞不会死亡,分裂不停止。也就是说这类病毒的潜伏期很长,有时可以终身带毒而不发病。
双链RNA病毒的复制
双链RNA病毒有两个特点,一是它的基因组为10-12条双链RNA分子;二是它有双层衣壳,而没有囊膜。病毒的RNA-RNA 聚合酶存在于髓核中,在该聚合酶的作用下病毒基因组转录正链RNA,它们自髓核逸出。它们既能作为mRNA,又能作为病毒基因组的模板。MRNA翻译结构蛋白,装配内层衣壳后,正链RNA进入,并形成双链RNA。然后又重复上述过程,最后获得了外层衣壳。
综上所述,病毒复制的特点表现在:一是利用寄主细胞的物质和能量进行病毒生物大分子的合成;二是复制周期短,繁殖效率高;三是反转录病毒的复制方式,丰富了遗传信息传递的中心法则。
负链RNA病毒复制
负链RNA病毒复制的大致过程是:首先病毒通过其表面糖蛋白与宿主细胞的特异性受体结合,接着病毒囊膜与细胞浆膜(即通过不依赖于PH途径)或有酸性环境的核内体膜(PH依赖途径)融合后释放病毒核糖核蛋白复合体(RNP)至细胞浆,在转录过程中每一mRNA得以合成,而通过复制产生全长反义基因组RNA,使其作为病毒基因组RNA的模板。很多负链RNA病毒在感染细胞的胞浆中复制,而一些正粘病毒和布尼亚病毒在细胞核中复制。新合成的RNP复合体与病毒结构蛋白在细胞浆膜或高尔基体膜组装,然后释放新合成的子代病毒。
在动物正链RNA病毒的研究上,1996年,Meyers G等构建了猪瘟病毒(Classical swine fever virus,CSFV)基因组全长cDNA克隆,将cDNA克隆体外转录后获得的RNA转染猪肾细胞后最终产生了有感染性的CSFV,虽然拯救出的带有遗传标记的CSFV比野生型生长能力上差一些,但仍具有感染性。这是较早的有关CSFV拯救的报道。此外,有报道首先建立表达T7 RNA 聚合酶的猪肾细胞系SK6,然后将CSFV基因组cDNA克隆线性化后转染该细胞系,结果成功拯救出与野生型CSFV生物学特性
一样的病毒,且病毒的效价比用体外制备转录本的方法高200倍,如对cDNA克隆不进行线性化直接用环型重组体进行转染,则拯救出的病毒效价高20倍。此外,在CSFV疫苗株C株的反向遗传研究上已有很多报道,其中在对标记疫苗、病毒复制、毒力和宿主特异性等方面都有相关报道。
RNA病毒提取方法
 RNA病毒
RNA病毒
2、 塑料器皿需用0.1% DEPC水浸泡。
3、 0.1%DEPC水:100ml dd水中加入DEPC0.1ml,充分振荡,37℃孵育12h以上,121℃高压灭菌20min,于4℃保存。
操作步骤
1、 样品处理
(1) 组织:50-100mg组织中加入1ml TROzlo试剂。
(2) 单层细胞:加入TROzlo试剂1ml/cm2平板。
(3) 悬浮细胞:处理前洗涤细胞,以防止RNA降解。每5-10×105动物、植物或酵母细胞,或1×107细菌加入1 ml TROzlo试剂。
2、 将上述样品于15-30℃静置5min,使核蛋白充分解离。
3、 加入0.2ml(1 ml TROzlo试剂)氯仿,盖紧盖子,充分剧烈振荡15s并于15-30℃静置2-3min。
4、 于2-8℃ 12000g离心15min。离心后样品分层,上层水相中含RNA,下层有机相中含蛋白和DNA。
5、 取上清,加入0.5ml异丙醇,轻轻混匀,于15-30℃静置10min后,在管底会出现胶状沉淀,即为RNA。
6、 于2-8℃ 12000g离心10min后弃去上清。
7、 向沉淀中加入1ml 75%乙醇,轻轻混匀。
8、 于2-8℃ 7500g离心5min后弃上清
9、 将RNA样品凉干(不要彻底干燥),加入适量DEPC水溶解(可于55-60℃促溶10min)。
注意问题
1、 在加入氯仿之前(第1步),样品能于-60- -70℃保存至少一个月。
2、 RNA沉淀(第6步)在75%乙醇中于2-8℃能保存至少一周,于-5- -20℃能保存至少一年。
四、 RNA定量
RNA(mg/mL)=40×OD260×稀释倍数(n)/1000
RNA纯品OD260/OD280=2.0
RNA电泳
(1)用1×TAE电泳缓冲液制作琼脂糖凝胶,加1×TAE电泳缓冲液至液面覆盖凝胶。
(2)在超净工作台上,用移液器吸取总RNA样品4μl于封口膜上。在实验台上再加入5μl 1×TAE电泳缓冲液及1μl 的10×载样缓冲液,混匀后,小心加入点样孔。
(3)打开电源开关,调节电压至100V,使RNA由负极向正极电泳,约30min后将凝胶放入EB染液中染色5min,用清水稍微漂洗。在紫外透射检测仪上观察RNA电泳结果。
装配与释放
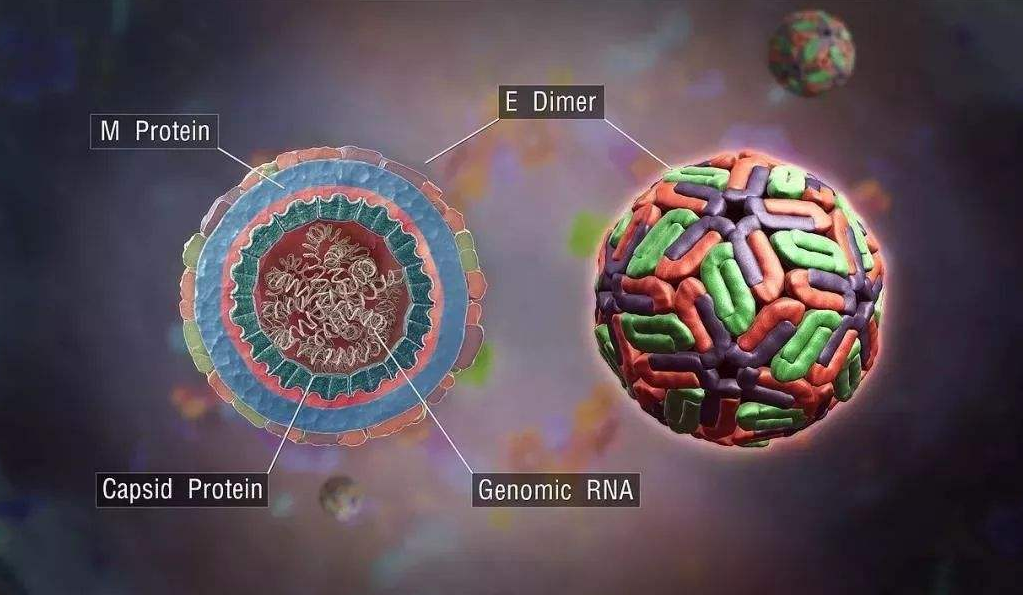 RNA病毒
RNA病毒
病毒装配成熟后释放的方式有:⑴宿主细胞裂解,病毒释放到周围环境中,见于无囊膜病毒,如腺病毒、脊髓灰质炎病毒等;⑵以出芽的方式释放,见于有囊膜病毒,如疱疹病毒在核膜上获得囊膜,流感病毒在细胞膜上获得囊膜而成熟,然后以出芽方式释放出成熟病毒。也可通过细胞间桥或细胞融合邻近的细胞。
病毒的增殖不只是产生有感染性的子代,绝大多数动物病毒在大量感染的情况下,经多次增殖会产生缺损干扰颗粒(Defective interfering particles),它是能干扰亲代病毒复制的缺损病毒,其核酸有部分缺损或被宿主DNA片段替换。缺损干扰颗粒的基本特性是:
⑴本身不能繁殖;
⑵有辅助病毒存在时方能增殖;
⑶干扰同种病毒而不干扰异种病毒的增殖;
⑷在感染细胞内与亲代病毒竞争性增殖。由于缺损干扰颗粒的产生,使同种感染性病毒数量减少,在导致病毒的持续性感染中具有一定的作用,但疫苗中含有大量缺损干扰颗粒会影响活疫苗的免疫效果。
反向遗传学研究
 RNA病毒
RNA病毒
与经典的从表型改变到进行基因特征研究的思路相反,反向遗传操作技术是指通过构建RNA病毒的感染性分子克隆,将病毒基因组RNA逆转录成cDNA,在DNA分子水平上对其进行体外人工操作,由病毒基因组cDNA和各种辅助蛋白来组装新的RNA病毒的一项技术。由于最终“拯救”出的RNA病毒来源于cDNA克隆,因此,可通过中间过程中人为加入的DNA环节,在DNA水平上对RNA病毒基因组进行各种体外人工操作,如进行基因突变、基因敲除(缺失)、基因插入、基因置换和基因互补(即构建嵌合病毒)等改造,以此来研究RNA病毒的基因复制和表达调控机理、RNA编辑和自发重组与诱导重组、病毒与宿主间的相互作用关系(如插入报告基因来研究病毒在宿主细胞间的传递机制)、抗病毒策略、基因治疗研究以及构建新型病毒载体表达外源基因和进行疫苗的研制等。
1976年Goff S. P等首先报道成功拯救出SV40 DNA病毒突变株,虽然拯救出的不是RNA病毒,但这是最早的有关病毒拯救的报道。1978年,Taniguchi T 等报道从全长cDNA克隆拯救出在细菌中有感染性的Qβ噬菌体。接着,基因组长约150kb的单纯疱疹病毒和长约190kb的痘苗病毒的重组病毒的成功拯救及有关研究是病毒学研究的领域重大突破。为在早期反向遗传操作体系的建立奠定了基础。
RNA病毒族与丙肝病毒
 RNA病毒
RNA病毒
丙肝病毒疫苗的研制“瓶颈”出现在RNA病毒的形态上面。DNA形态通常比较稳定,因此,任何依次,DNA病毒的复制,都与“原版”DNA高度一致,因此可以研制出许多用于预防乙肝病毒疫苗。与此相反,RNA病毒在复制过程中会发生错误的“拼写检查”,RNA病毒的变异速度比DNA病毒快100万倍,而且体形经常改变。这就使得丙肝等RNA病毒的疫苗研制很难。即使某天研制出丙肝病毒疫苗,每年还是要根据新出现的变异丙肝病毒不断研制新的疫苗。
丙肝变幻莫测,对人类健康危害极大,我们怎样才能保护自己免受丙肝的感染呢?最佳方法就是尽早了解RNA致命病毒的本质,及其感染和传播的原理。进行早期诊断和治疗也非常必要,判断是否感染丙肝的唯一办法是做丙肝测试,以确保在病毒侵害肝部之前进行治疗。专家们建议,在丙型肝炎高危人群中进行丙型肝炎抗体检查刻不容缓。有输血史或是用静脉注射毒品、多个性伙伴者,以及经常和血液接触的医护人员,美容师,牙医,警察等都因该考虑接受丙肝检查。
双RNA病毒科
流感病毒
 RNA病毒
RNA病毒
流感病毒是一种RNA病毒,医学上根据其抗原性差异来进行分类,主要有甲、乙、丙三种类型的病毒。由于流感病毒的抗原特性很不稳定,很容易发生变异,因而每一类型病毒中又出现了很多的亚类型。尤其是甲型流感病毒,其毒性最强,最容易发生变异,临床常可以引起严重的大暴发流行。乙型流感病毒对人类的致病力较低,仅引起局部地区散发的小流行。而丙型流感病毒仅引起人类不明显的或轻微的上呼吸道感染,多为散发性,极少造成流行。
流感伴随人类的发病已有很长的时间了,历史上曾记载过很多次大规模的暴发流行。如1918年发生了一次流感的大流行,流感病毒在几个月的时间内横扫全世界,致使1000多万人因此而死亡。又如五十年代,中国也曾爆发流感,之后,该病毒又经香港向全世界传播开来,4个月内横扫世界各大洲。据研究,这些大流行的“罪魁祸首”都是甲型流感病毒及其变异的甲亚型流感病毒所致。
肠道病毒
肠道病毒是一种主要生长于肠道的RNA病毒,虽然名为肠道病毒,但感染后很少出现腹泻、腹痛等胃肠道症状。肠道感染是指胃肠消化道被微生物感染,感染的微生物包括各种细菌、真菌、病毒等,一般具有明显的胃肠道症状,如腹痛、腹泻。肠道感染多由细菌所致,以革兰氏阴性菌为主,主要致病菌为志贺氏菌、鼠伤寒沙门氏菌及大肠埃希菌等。我们日常生活中说的肠炎、痢疾都属于肠道感染。
肠道病毒属 由于能感染人、牛、猪等的肠道而得名。在pH3的溶液中稳定,氯化铯浮力密度为1.33~1.45。人的肠道病毒原来包括3个种:①脊髓灰质炎病毒3个型;②库克萨基病毒A组23个型,B组6个型;③埃柯病毒31个型。
后来发现这种分类带有人为性质,所以自68型起统一按肠道病毒编号分型,目前已有肠道病毒68、69、70、71、72型(人)。在畜禽肠道病毒中,重要的有猪水疱病病毒、猪脑脊髓炎病毒、鸡脑脊髓炎病毒和鸭肝炎病毒等。
脊髓灰质炎病毒 又称小儿麻痹病毒,大多引起隐性感染,只有约1%产生明显的临床症状,如顿挫型、非麻痹型和麻痹型脊髓灰质炎,也可引起无菌性脑膜炎。脊髓灰质炎可注射灭活疫苗或口服减毒活疫苗预防,效果很好。可控制流行的发生。
本病毒因最初于美国的库克萨基地区被分离到而得名。可引起无菌性脑膜炎、疱疹性咽峡炎、胸壁痛、手口足病、心肌病等。A7型尚可引起麻痹型脊髓灰质炎。
ECHO(埃柯)系Enteric cytopathic hu-man orphan的缩写,意为肠道内致细胞病变的人类孤儿病毒。在刚分离出病毒时,尚不知所引起的疾病,所以称为“孤儿”。后来才知道它可引起无菌性脑膜炎、红疹、普通感冒等疾病。
68~71型肠道病毒 68型可引起肺炎和细支气管炎,69型致病性不明,70型可引起急性出血性结膜炎,71型可引起致死性脑炎和麻痹型脊髓灰质炎。
甲型肝炎病毒(HAV) 又称72型病毒,直径27纳米,其RNA的分子量为1.9×106。只有 1个血清型。易感者除人外,尚有黑猩猩、南美的白唇猴和狨猴。中国红面猴也可感染。近年已在猴胚肾细胞和人肺二倍体细胞上培养成功。甲型肝炎潜伏期为15~40天。潜伏期的后期和发病早期,病毒由粪便排出,有传染性。患病后可获终身免疫力。愈后良好,很少转为慢性。
猪水疱疹病毒(SVDV) 只有 1个血清型。与人的库克萨基病毒B5型有共同抗原,免疫血清能交互中和。猪是唯一的自然宿主,主要经伤口感染。在口腔粘膜、鼻头、乳房、蹄部发生水疱,外观与口蹄疫难以分辨。病毒主要存在于水疱皮和疱液中,内脏和肌肉含病毒量极微。疱皮中的病毒能抗强酸强碱。病毒可用猪原代肾细胞或传代细胞培养并产生病变。接种乳鼠弱毒疫苗、组织培养弱毒疫苗、水疱皮和疱液灭活疫苗能控制本病的流行。
猪脑病毒(PEV) 有两个亚型,捷克猪捷申病病毒和英国猪太法病病毒。除美洲和亚洲外,世界许多国家都已发现。主要病变为中枢神经灰质坏死,病死率90~100%。灭活疫苗有一定效果,但未能完全控制此病。
鸡脑脊髓炎病毒(AEV) 单一血清型。自然病毒株均有嗜肠性,鸡胚适应的Van Roekel株有高度嗜神经性。经粪便和蛋传播,雏鸡、鹌鹑、雉均可被自然感染。人工接种可感染小鸭和小鸽。病毒可用易感雏鸡神经胶质细胞或纤维母细胞进行培养。可用疫苗预防。
鸭肝炎病毒(DHV) 可感染2周龄以下的小鸭,成年鸭、鸡、鹅都不感染。人工接种1~7日龄雏火鸡能发病。此病在欧、亚、美3洲均有发生。从粪中排病毒,由消化道感染。可用鸭胚或鸡胚细胞培养病毒。母鸭可在产蛋前2~4周接种弱毒疫苗,使蛋黄中有足够的抗体,以保护雏鸭。
鼻病毒属 能感染人、马、牛的鼻腔而得名。
人患普通感冒的主要病原。与肠道病毒的区别如下:①不耐酸,pH3~5溶液中易被破坏;②人肾细胞中只在33℃旋转培养物中才能很好繁殖,而肠道病毒在36~37℃静止培养可繁殖;③比重大,氯化铯浮力密度为1.38~1.42。鼻病毒抗原性复杂,有100多个血清型。感染后可获得免疫力,但维持时间短,不同型鼻病毒之间很少交叉保护,因而人可多次患感冒。对普通感冒尚无特异预防和治疗方法。
心病毒属 代表种为鼠脑心肌炎病毒,不耐酸。氯化铯浮力密度1.34,RNA含量31%。只有1个血清型。
口疮病毒属 因代表种口蹄疫病毒引起口疮而得名。直径23~25纳米,氯化铯浮力密度1.43~1.45,RNA含量31.5%,不耐酸。
病毒 病毒抗原性易变异。已发现A、O、C、Asia I、SAT1、SAT2、SAT37个正型和 60多个亚型。能自然感染偶蹄动物,以牛、猪最为易感。人也可被感染,但症状轻。病毒对初生幼畜感染性强,有些毒株对牛致病力强而对猪致病力弱,有些毒株则相反。1981年,用基因工程技术已培育出带有口蹄疫免疫原性蛋白基因的细菌,将用于制造疫苗。
相关信息
80多年前有一个至少在全球造成2000万人死亡的凶手,它还从未接受正义的审判,它就是著名的“西班牙流感病毒”。科学家相信,研究恶贯满盈的1918年“西班牙流感”可能有助于人类防范另一场灾难性流感的袭击。今天,1918年在人们的记忆中是模糊的。那年,第一次世界大战以同盟国的战败投降而告终。战争造成了1000多万人死亡,更多的人流离失所。在经历了4年之久的惨烈战争后,人们盼望着和平宁静的生活。然而就在此刻,一场更大规模的灾难使得一次大战的死亡幽灵相形见绌。这场在很多历史书中只是一则小小脚注的灾难,就是所谓的“西班牙流感”。
最危险的感冒
“西班牙流感”也被称作“西班牙女士”(SpanishLady),不过它却有些名不符实。首先,它似乎并不是从西班牙起源的。其次,这场流感绝对没有它的名称那样温柔。现有的医学资料表明,“西班牙流感”最早出现在美国堪萨斯州的芬斯顿(Funston)军营。1918年3月11日午餐前,这个军营的一位士兵感到发烧、嗓子疼和头疼,就去部队的医院看病,医生认为他患了普通的感冒。然而,接下来的情况出人意料:到了中午,100多名士兵都出现了相似的症状。几天之后,这个军营里已经有了500名以上的“感冒”病人。在随后的几个月里,美国全国各地都出现了这种“感冒”的踪影。这一阶段美国的流感疫情似乎不那么严重,与往年相比,这次流感造成的死亡率高不了多少。在一场世界大战尚未结束时,军方很少有人注意到这次流感的爆发———尽管它几乎传遍了整个美国的军营。
随后,流感传到了西班牙,总共造成800万西班牙人死亡,这次流感也就得名“西班牙流感”。9月,流感出现在波士顿,这是“西班牙流感”最严重的一个阶段的开始。10月,美国国内流感的死亡率达到了创纪录的5%。战争中军队大规模的调动为流感的传播火上浇油。有人怀疑这场疾病是德国人的细菌战,或者是芥子气引起的。 这次流感呈现出了一个相当奇怪的特征。以往的流感总是容易杀死年老体衰的人和儿童,这次的死亡曲线却呈现出一种“W”型———20岁到40岁的青壮年人也成为了死神追逐的对象。到了来年的2月份,“西班牙流感”迎来了它相对温和的第三阶段。 数月后,“西班牙流感”在地球上销声匿迹了。不过,它给人类带来的损失却是难以估量的。科学家估计,大约有2000万到4000万人在流感灾难中丧生。相比之下,第一次世界大战造成的1000万人死亡只有它的1/2到1/4。据估计,在这场流感之后,美国人的平均寿命下降了10年。
善于化装的凶手
作为一种传染病,流感至少已经有了2000多年的历史。1918年“西班牙流感”的危害甚至超过了中世纪欧洲爆发的鼠疫,与最近20年流行的艾滋病打了一个平手(全球大约有7000万人感染艾滋病,2000万人死亡)。 流行性感冒是比你想象的更严重的疾病。即便流感只有2.5%的死亡率,如果有10亿人感染,那么后果就是“西班牙流感”这样的灾难。流感的另一个危险之处是它的不稳定性:今年你患上了流感,你得到了一定的免疫力。但是你可能仍然逃不过明年的那场流感。相比之下,风疹或者天花之类的传染病只要患过一次就能获得终身的免疫力。
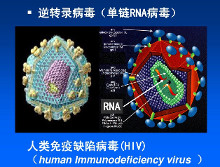
流感病毒的结构决定了它总是能侵害你。流感病毒的遗传物质是单链的核糖核酸(RNA),而不是你我身体中的遗传物质DNA。有两种蛋白质像大头针一样“扎”在流感病毒的蛋白质外壳上,一种叫做血凝素(HA),另一种叫做神经氨酸酶(NA)。HA和NA的作用是负责让病毒———准备入侵细胞的和已经在细胞内复制、组装好的———顺利进出细胞。人体的免疫系统也正是以HA和NA作为“靶子”。如果指导HA和NA合成的流感病毒RNA发生了变化(这种变化发生的可能性要比DNA变化的可能性大),那么人体免疫系统就对改变了结构的HA和NA“视而不见”。直到流感痊愈,你终于获得了对新的HA和NA的识别能力,不过很不幸:下一次流感病毒的HA和NA可能又变得让你的免疫系统无法识别了。 迄今为止已经发现了15种HA和9种NA。科学家使用HA和NA区别各种流感病毒的身份,例如1968年的“香港型”流感被称作H3N2。
尽管大多数人可能不知道或者早已忘记1918年的“西班牙流感”,科学家却一直保持着警惕。弄清85年前的那场灾难的原因有助于防止悲剧的重演。寻找将近一个世纪之前的疾病的病因并不是一件简单的事。直到1930年代,人类才分离出流感病毒。1950年代,美国曾经组织了考察队赶赴阿拉斯加挖掘死于1918年“西班牙流感”的病人的尸体,期望得到可供研究的病原体。很遗憾,那些埋葬在永久冻土带的尸体因为解冻腐烂而失去了研究价值。
直到1997年,美国军事病理研究所的病理学家陶本伯杰(JefferyTaubenberger)领导的一个研究小组才第一次找到造成“西班牙流感”的感冒病毒RNA片断。陶本伯杰所在的研究所保留了将近一个世纪以来病人的组织样本,包括一些浸泡在福尔马林中的“西班牙流感”病人的肺组织。在28份当年的样本中,只有一位21岁士兵的肺部样本完全符合当时“西班牙流感”的状况。正是在这份标本中,陶本伯杰用逆转录聚合酶链反应的方法找到了9段当年流感病毒的RNA“碎片”。RNA比DNA更容易分解,但是陶本伯杰发现的RNA片断已经能够提供一些“西班牙流感”病毒的线索了。这9段RNA片断分属5个不同的基因,其中包括制造HA和NA的基因。
通过比较,陶本伯杰发现造成“西班牙流感”大流行的病毒与猪流感有相似之处,如果把它归类,那么它应该是H1N1型的。此前的理论认为,造成1918年流感大流行的病原体,可能是一种禽流感。 2001年,澳大利亚的科学家吉布斯(MarkGibbs)在陶本伯杰的基础上有了进一步的发现。吉布斯把1918年流感病毒中负责制造HA的基因与30种类似的猪流感、禽流感、人类流感病毒中的相同基因进行对比,结果发现了一个很有趣的现象:在这个基因的前部和后部是人类流感病毒的编码,而在基因的中段则是猪流感病毒的编码。吉布斯认为,造成1918年全球流感大流行的原因,就是猪流感病毒的一段编码“跳”到了人类流感病毒的RNA中。
继续追踪
然而,也有一些科学家认为吉布斯的证据不够充分。他们认为,这种人类流感病毒的HA基因和猪流感病毒的HA基因“混合”(科学家称之为“重组”)的可能性不大。陶本伯杰更是认为,吉布斯“错误理解”了他的数据。
要完全认识“西班牙流感”为什么如此凶恶,可能需要测出它的基因组的全部序列。 一些科学家正在试图挖开更多的死于1918年流感的人的坟墓。伦敦的玛丽王后医学院教授奥克斯福德(JohnOxford)就是其中之一。去年,他打算从伯恩(PhyllisBurn,一位住在伦敦南部的20岁的女性)的尸体中采集肺部样本。伯恩当年因“西班牙流感”而去世,她被安葬在一个灌满了酒精的密封铅制棺材中。牛津相信,在伯恩的体内保存有完好的“西班牙流感”病毒。 重新调查“西班牙流感”有一定的危险性。科学家建议在生物安全性最好的实验室中进行研究,以免“西班牙流感”病毒———假如真的能完整找到的话———泄漏出实验室,再度危害人类。不过相比之下,大自然才是终极的“生物恐怖分子”。研究表明,野生的水禽是感冒病毒的“基因库”———它们拥有全部15种HA基因和9种NA基因。而猪由于既能感染水禽身上的流感病毒,又能感染人类流感病毒,它很可能会成为一种病毒的“混合器”,即产生了拥有新的HA和NA的流感病毒。这样一来,人类的免疫系统就可能面临一场像1918年那样的严峻考验。
数十年来,世界卫生组织(WHO)在全世界系统地监视人类流感病毒的变化趋势,但是对于猪流感,却没有一个很好的监视系统。今年2月份,在WHO的一次关于流感疫苗的会议上,病毒学家韦伯斯特(RobertWebster)提议,WHO应研制储备针对所有15种HA的疫苗,以防止类似1918年“西班牙流感”的出现。 科学家们还在继续追踪“西班牙流感”。用陶本伯杰的话说,80多年前这个恶贯满盈的凶手,还从未接受正义的审判。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













