-
醋酸
 醋酸
醋酸
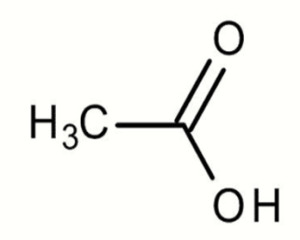
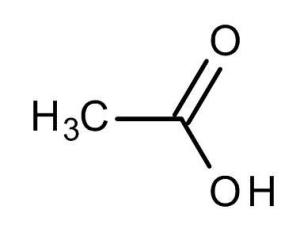
醋酸(AceticAcid)是一种有机一元酸,化学式CH3COOH,为食醋主要成分。
醋酸也叫乙酸、冰醋酸,纯的无水乙酸(冰醋酸)是无色的吸湿性固体,凝固点为16.6℃(62℉),凝固后为无色晶体,其水溶液中呈弱酸性且蚀性强,蒸汽对眼和鼻有刺激性作用。
目录
- 1 基本信息
2 简介
3 物理性质
4 化学性质
5 作用
6 制备方法
7 生产工艺
8 分析检测方法
9 毒理学资料
10 安全性与防护
11 管理信息
基本信息
中文名:醋酸
别称:乙酸、冰醋酸
分子量:60.05
熔点:16.6℃
水溶性:能溶于水
外观:无色液体
作用:酸度调节剂、酸化剂、腌渍剂
属性:有机一元酸
EINECS号:EINECS号:200-580-7
英文名:Acetic Acid
化学式:CH3COOH
CAS登录号:64-19-7
沸点:117.9℃
密度:1.050
闪点:39℃
20℃时蒸气压:1.5KPa
气味:刺鼻的醋酸味
简介
 醋酸
醋酸
乙酸是醋的主要成分,而醋几乎贯穿了整个人类文明史。乙酸发酵细菌(醋酸杆菌)能在世界的每个角落发现,每个民族在酿酒的时候,不可避免的会发现醋——它是这些酒精饮料暴露于空气后的自然产物。如中国就有杜康的儿子黑塔因酿酒时间过长得到醋的说法。
古罗马的人们将发酸的酒放在铅制容器中煮沸,能得到一种高甜度的糖浆,叫做“sapa”。“sapa”富含一种有甜味的铅糖,即乙酸铅。公元8世纪时,波斯炼金术士贾比尔,用蒸馏法浓缩了醋中的乙酸。
文艺复兴时期,人们通过金属醋酸盐的干馏制备冰醋酸。16世纪德国炼金术士安德烈亚斯·利巴菲乌斯就把由这种方法产生的冰醋酸和由醋中提取的酸进行了比较。因为水的存在,导致了醋酸的性质发生很大改变,以至于在几个世纪里,化学家们都认为这是两个截然不同的物质。直到法国化学家阿迪(Pierre Adet)证明了这两种物质的主要成分是相同的。
1847年,德国科学家阿道夫·威廉·赫尔曼·科尔贝第一次通过无机原料合成了乙酸。反应历程如下:首先是二硫化碳经过氯化转化为四氯化碳,接着是四氯乙烯的高温分解后水解并氯化,从而产生三氯乙酸,最后一步通过电解还原产生乙酸。
1910年时,大部分的冰醋酸提取自干馏木材得到的煤焦油。其工艺首先是将煤焦油通过氢氧化钙处理,然后将形成的乙酸钙用硫酸酸化,得到其中的乙酸。1911年,在德国建成了世界上第一套乙醛氧化合成乙酸的工业装置装置,随后研发了低碳烷烃氧化生产乙酸的方法。
物理性质
 醋酸
醋酸
其他名:冰醋酸,醋酸
适应症:本品不同浓度用以治疗各种皮肤浅部真菌感染,灌洗创面及鸡眼、疣的治疗。
药品分类:消毒防腐剂-冰醋酸
分子量:60.05
分子式:CH3COOH
沸点(℃):117.9
凝固点(℃):16.6
相对密度(水为1):1.050
粘度(mPa.s):1.22(20℃)
20℃时蒸气压(KPa):1.5
外观及气味:无色液体,有刺鼻的醋酸味。
溶解性:能溶于水、乙醇、乙醚、四氯化碳及甘油等有机溶剂。
相容性材料:稀释后对金属有强烈腐蚀性,316#和318#不锈钢及铝可作良好的结构材料。
国家产品标准号:GB/T 676-2007
下为中华人民共和国关于工业乙酸的国家标准:
| 指标名称 | 指标 | ||
|---|---|---|---|
| 优等品 | 一等品 | 合格品 | |
| 色度,Hazen 单位(铂-钴色号)≤ | 10 | 20 | 30 |
| 乙酸含量,% ≥ | 99.8 | 99.0 | 98.0 |
| 水分,% ≤ | 0.15 | - | - |
| 甲酸含量,% ≤ | 0.06 | 0.15 | 0.35 |
| 乙醛含量,% ≤ | 0.05 | 0.05 | 0.10 |
| 蒸发残渣,% ≤ | 0.01 | 0.02 | 0.03 |
| 铁含量(以Fe 计),% ≤ | 0.00004 | 0.0002 | 0.0004 |
| 还原高锰酸钾物质, min ≥ | 30 | 5 | - |
化学性质
 醋酸
醋酸
乙酸二聚物
乙酸的晶体结构显示 ,分子间通过氢键结合为二聚体(亦称二缔结物),二聚体也存在于120℃的蒸汽状态。二聚体有较高的稳定性,已经通过冰点降低测定分子量法以及X光衍射证明了分子量较小的羧酸如甲酸、乙酸在固态及液态,甚至气态以二聚体形式存在。当乙酸与水溶和的时候,二聚体间的氢键会很快的断裂。其它的羧酸也有类似的二聚现象。
无机化学反应
1.乙酸能发生普通羧酸的典型化学反应,同时可以还原生成乙醇,通过亲核取代机理生成乙酰氯,也可以双分子脱水生成酸酐。
乙酸的典型化学反应:
乙酸与碳酸钠:2CH3COOH+Na2CO3==2CH3COONa+CO2↑+H2O
乙酸与碳酸钙:2CH3COOH+CaCO3==(CH3COO)2Ca+CO2↑+H2O
乙酸与碳酸氢钠:NaHCO3+CH3COOH==CH3COONa+H2O+CO2↑
乙酸与碱反应:CH3COOH+OH-==CH3COO-+H2O
乙酸与弱酸盐反应:2CH3COOH+CO32-==2CH3COO-+H2O+CO2↑
乙酸与活泼金属单质反应:Fe+2CH3COOH==(CH3COO)2Fe+H2↑
Zn+2CH3COOH==(CH3COO)2Zn +H2↑
2Na+2CH3COOH==2CH3COONa+H2↑
乙酸与氧化锌反应:2CH3COOH+ZnO==(CH3COO)2Zn+H2O
乙酸与乙醇反应:CH3COOH+C2H5OH=△=CH3COOC2H5+H2O(注:条件是加热,浓硫酸催化,可逆反应)
2.乙酸也可以成酯或氨基化合物。如乙酸可以与乙醇在浓硫酸存在并加热的条件下生成乙酸乙酯(本反应为可逆反应,反应类型属于取代反应中的酯化反应)。
CH3COOH + CH3CH2OH<==> CH3COOCH2CH3+ H2O
3.由于弱酸的性质,对于许多金属,乙酸是有腐蚀性的,例如铁、镁和锌,反应生成氢气和金属乙酸盐。虽然铝在空气中表面会形成氧化铝保护层,但是在醋酸的作用下,氧化膜会被破坏,内部的铝就可以直接和酸作用了。
4.金属的乙酸盐也可以用乙酸和相应的碱性物质反应,比如小苏打与醋的反应。除了醋酸铬(II),几乎所有的醋酸盐能溶于水。
Mg(S)+ 2 CH3COOH(aq)→ (CH3COO)2Mg(aq) +H2(g)
NaHCO3(s)+ CH3COOH(aq) →CH3COONa(aq) +CO2(g) +H2O(l)
5.在440℃的高温下,乙酸可分解生成甲烷和二氧化碳或乙烯酮和水。
生物化学反应
乙酸中的乙酰基,是生物化学中所有生命的基础。当它与辅酶A结合后,就成为了碳水化合物和脂肪新陈代谢的中心。然而,乙酸在细胞中的浓度是被严格控制在一个很低的范围内,避免使得细胞质的pH发生破坏性的改变。与其它长链羧酸不同,乙酸并不存在于甘油三酸脂中。但是,人造含乙酸的甘油三酸脂,又叫甘油醋酸酯(甘油三乙酸酯),则是一种重要的食品添加剂,也被用来制造化妆品和局部性药物。
乙酸由一些特定的细菌生产或分泌。值得注意的是醋菌类梭菌属的丙酮丁醇梭杆菌,这个细菌广泛存在于全世界的食物、水和土壤之中。在水果或其他食物腐败时,醋酸也会自然生成。乙酸也是包括人类在内的所有灵长类生物的阴道润滑液的一个组成部分,被当作一个温和的抗菌剂。
作用
 醋酸
醋酸
制备方法
 醋酸
醋酸
有氧发酵法
在氧气充足的情况下,醋杆菌属细菌能够从含有酒精的食物中生产出乙酸。通常使用的是苹果酒或葡萄酒混合谷物、麦芽、米或马铃薯捣碎后发酵。由这些细菌发酵反应的化学方程式为:
C₂H5OH + O₂ →CH₃COOH + H₂O
具体做法是将醋菌属的细菌接种于稀释后的酒精溶液并保持一定温度,放置于一个通风的位置,在几个月内就能够经过发酵,最后生成醋。工业生产醋的方法通过提供充足的氧气使得反应过程加快,此方法已经被商业化生产采用,也被称为“快速方法”或“德国方法”,因为首次在德国1823年应用成功而因此得名。此方法中,发酵是在一个塞满了木屑或木炭的塔中进行。含有酒精的原料从塔的上方滴入,新鲜空气从下方自然进入或强制对流。强化的空气量使得此过程能够在几个星期内完成,大大缩短了制醋的时间。
Otto Hromatka和Heinrich Ebner在1949年首次提通过液态的细菌培养基制备醋。在此方法中,酒精在持续的搅拌中发酵为乙酸,空气通过气泡的形式被充入溶液。通过这个方法,含乙酸15%的醋能够在两至三天制备完成。
无氧发酵法
部分厌氧细菌,包括梭菌属的部分成员,能够将糖类直接转化为乙酸而不需要乙醇作为中间体。总体反应方程式如下:
C6H12O6==3 CH3COOH
此外,许多细菌能够从仅含单碳的化合物中生产乙酸,例如甲醇,一氧化碳或二氧化碳与氢气的混和物。
2 CO2+ 4 H2→CH3COOH + 2 H2O
2 CO + 2 H2→CH3COOH
梭菌属因为有能够反应糖类的能力,减少了成本,这意味着这些细菌有比醋菌属细菌的乙醇氧化法生产乙酸更有效率的潜力。然而,梭菌属细菌的耐酸性不及醋菌属细菌。耐酸性最大的梭菌属细菌也只能生产不到10%的乙酸,而有的醋酸菌能够生产20%的乙酸。使用醋酸属细菌制醋仍然比使用梭菌属细菌制备后浓缩更经济。所以,尽管梭菌属的细菌早在1940年就已经被发现,但它的工业应用范围较窄。
除了上述生物法外,工业用乙酸多采用如下方法合成:
甲醇羰基化法
大部分乙酸是通过甲基羰基化合成的。此反应中,甲醇和一氧化碳反应生成乙酸,方程式如下
CH3OH + CO →CH3COOH
这个过程是以碘代甲烷为中间体,分三个步骤完成,并且需要多金属成分的催化剂(第二步中)
⑴ CH₃OH + HI →CH₃I + H₂O
⑵ CH₃I + CO →CH₃COI
⑶ CH₃COI + H₂O →CH₃COOH + HI
通过控制反应条件,也可以通过同样的反应生成乙酸酐。因为一氧化碳和甲醇均是常用的化工原料,所以甲基羰基化一直以来备受青睐。早在1925年,英国塞拉尼斯公司就开发出第一个甲基羰基化制乙酸的试点装置。然而,由于缺少能耐高压(200atm或更高)和耐腐蚀的容器,此方法的应用一直受到限制。1963年,德国巴斯夫化学公司用钴作催化剂,开发出第一个适合工业生产乙酸的工艺。1968年,铑催化剂的大大降低了反应难度。采用铑的羰基化合物和碘化物组成的催化剂体系,使甲醇和一氧化碳在水-乙酸的介质中在175℃和低于3兆帕的压力条件下反应,即可得到乙酸产品。因为催化剂的活性和选择性都比较高,所以反应的副产物很少。甲醇低压羰基化法制乙酸,具有原料价廉,操作条件缓和,乙酸产率高,产品质量好和工艺流程简单等优势,但反应介质有严重的腐蚀性,需要使用耐腐蚀的特殊材质。1970年,美国孟山都公司建造了采用此工艺的装置,因此铑催化甲基羰基化制乙酸逐渐成为支配性的孟山都法。90年代后期,英国石油成功的将Cativa催化法商业化,此方法采用钌催化剂,使用(),它比孟山都法更加绿色也有更高的效率。
乙醛氧化法
在孟山都法商业生产之前,大部分的乙酸是由乙醛氧化制得。尽管不能与甲基羰基化相比,此法仍然是第二种工业制乙酸的方法,反应方程式如下:
2CH₃CHO+O₂→2CH₃COOH
乙醛可以通过氧化丁烷或轻石脑油制得,也可以通过乙烯水合后生成。
低碳烷烃液相氧化法
采用正丁烷为原料,以乙酸为溶剂,在170℃-180℃,5.5兆帕和乙酸钴催化剂存在下,用空气为氧化剂进行氧化。同时此方法也可采用液化石油气或轻质油为原料。此方法原料成本低,但工艺流程较长,腐蚀严重,乙酸收率不高,仅限于廉价异丁烷或液化石油气原料来源易得的地区采用。
2 C₄H₁₀ + 5 O₂ →4 CH₃COOH + 2 H₂O
此反应可以在能使丁烷保持液态的最高温度和压力下进行,副产物包括丁酮,乙酸乙酯,甲酸和丙酸。因为部分副产物也有经济价值,所以可以调整反应条件使得副产物更多的生成,不过分离乙酸和副产物使得反应的成本增加。
在类似条件下,使用上述催化剂,乙醛能被空气中的氧气氧化生成乙酸:
2 CH₃CHO + O₂ →2 CH₃COOH
也能被氢氧化铜悬浊液氧化:
2Cu(OH)₂+CH₃CHO→CH₃COOH+Cu₂O↓+2H₂O
使用新式催化剂,此反应能获得95%以上的乙酸产率。主要的副产物为乙酸乙酯,甲酸和甲醛。因为副产物的沸点都比乙酸低,所以很容易通过蒸馏除去。
乙烯氧化法
由乙烯在催化剂(所用催化剂为氯化钯:PdCl₂、氯化铜:CuCl₂和乙酸锰:(CH₃COO)₂Mn)存在的条件下,与氧气发生反应生成。此反应可以看作先将乙烯氧化成乙醛,再通过乙醛氧化法制得。
托普索法
托普索法以单一天然气或煤为原料。第一步:合成气在催化剂下生成甲醇和二甲醚;第二部:甲醇和二甲醚(两者不需提纯)和CO羰基化生成醋酸,此方法也叫做两步法。
生产工艺
 醋酸
醋酸
塞拉尼斯AOPlus工艺
塞拉尼斯公司也是世界上最大的醋酸生产商之一。1978年,赫斯特-塞拉尼斯公司(现塞拉尼斯公司)在美国得州克莱尔湖工业化投运了孟山都法醋酸装置。1980年,塞拉尼斯公司推出AOPlus法(酸优化法)技术专利,大大改进了孟山都工艺。
AOPlus工艺通过加入高浓度无机碘(主要是碘化锂)以提高铑催化剂的稳定性,加入碘化锂和碘甲烷后,反应器中水浓度降低至4%~5%,但羰基化反应速率仍保持很高水平,从而极大地降低了装置的分离费用。催化剂组成的改变使反应器在低水浓度(4%~5%)下运行,提高了羰基化反应产率和分离提纯能力。
用途
乙酸是大宗化工产品,是最重要的有机酸之一。主要可用于生产乙酸乙烯、乙酐、乙酸酯和乙酸纤维素等。聚乙酸乙烯酯可用来制备薄膜和粘合剂,也是合成纤维维纶的原料。乙酸纤维苏可制造人造丝和电影胶片。乙酸酯是优良的溶剂,广泛用于油漆工业。乙酸还可用来合成乙酐、丙二酸二乙酯、乙酰乙酸乙酯、卤代乙酸等,也可制造药物如阿司匹林、还可以用于生产乙酸盐等。在农药、医药和染料、照相药品制造、织物印染和橡胶工业中都有广泛应用。
在食品工业中,乙酸用作酸化剂,增香剂和香料。制造食醋时,用水将乙酸稀释至4~5%浓度,添加各种调味剂而得食用醋。作为酸味剂,使用时适当稀释,可用于调饮料、罐头等,如制作蕃茄、芦笋、婴儿食品、沙丁鱼、鱿鱼等罐头,可制作软饮料,冷饮、糖果、焙烤食品、布丁类、胶媒糖、调味品等。
乙酸具有防腐剂的作用。1.5%就有明显的抑菌作作用。在3%范围以内,可避免霉斑引起的肉色变绿变黑。
分析检测方法
方法名称:冰醋酸—冰醋酸的测定—中和滴定法
应用范围:该方法采用滴定法测定冰醋酸中冰醋酸的含量。
该方法适用于冰醋酸。
方法原理:供试品加新沸过的冷水与酚酞指示液,用氢氧化钠滴定液滴定,根据滴定液使用量,计算冰醋酸的含量。
试剂:
1. 氢氧化钠滴定液(1mol/L)
2. 酚酞指示液(酚酞指示液不变色)
3. 基准邻苯二甲酸氢钾
4.紫色石蕊溶液(紫色石蕊溶液变红)
仪器设备:
试样制备:1.氢氧化钠滴定液(1mol/L)
配制:取氢氧化钠适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。取澄清的氢氧化钠饱和溶液56mL,加新沸过的冷水使成1000mL,摇匀。
标定:取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,精密称定,加新沸过的冷水50mL,振摇,使其尽量溶解,加酚酞指示液2滴,用本液滴定,在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。每1mL氢氧化钠滴定液(1mol/L)相当于204.2mg的邻苯二甲酸氢钾。根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。
贮藏:置聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。
2.酚酞指示液
取酚酞1g,加乙醇100mL使溶解。
操作步骤:取供试品约4mL,置称定重量的具塞锥形瓶中,精密称定,加新沸过的冷水40mL与酚酞指示液3滴,用氢氧化钠滴定液(1mol/L)滴定。每1mL氢氧化钠滴定液(1mol/L)相当于60.05mg的C₂H₄O₂。
注:“精密称取”系指称取重量应准确至所称取重量的千分之一。“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精度要求。
毒理学资料
急性毒性:LD50:3.3 g/kg(大鼠经口);1060 mg/kg(兔经皮)。LC50:5620 ppm,1 h(小鼠吸入);12.3 g/m3,1 h(大鼠吸入)。人经口1.47 mg/kg,最低中毒量,出现消化道症状;人经口20~50 g,致死剂量。80%浓度的醋酸能导致豚鼠皮肤的严重灼伤,50%~80%产生中等度至严重灼伤,小于50%则很轻微,5%~16%浓度从未有过灼伤。人不能在2~3 g/m3浓度中耐受3 min以上。人的口服致死量为20~50 g。
亚急性和慢性毒性:本品浓度在100 mg/m3左右时慢性作用可使工人的鼻、鼻咽、睑和咽喉发生炎症反应,甚至引起支气管炎。人吸入(200~490)mg/m3×(7~12)年,有眼睑水肿、结膜充血、慢性咽炎、支气管炎等症状。
致突变性:微生物致突变:大肠杆菌300 ppm(3 h)。姊妹染色单体交换:人淋巴细胞5 mmol/L。
生殖毒性:大鼠经口最低中毒剂量(TDL0):700 mg/kg(18 d,产后),对新生鼠行为有影响。大鼠睾丸内最低中毒剂量(TDL0):400 mg/kg(1 d,雄性),对雄性生育指数有影响。
健康危害:侵入途径为吸入、食入、经皮吸收。吸入后对鼻、喉和呼吸道有刺激性。对眼有强烈刺激作用。皮肤接触,轻者出现红斑,重者引起化学灼伤。误服浓乙酸,口腔和消化道可产生糜烂,重者可因休克而致死。
慢性影响:眼睑水肿、结膜充血、慢性咽炎和支气管炎。长期反复接触,可致皮肤干燥、脱脂和皮炎。
环境危害:对环境有危害,对水体可造成污染。
安全性与防护
闪点(℃):39
爆炸极限(%):4.0~17
静电作用:可能有聚合危害
燃烧性:自燃温度:463℃
危险特性:能与氧化剂发生强烈反应,与氢氧化钠与氢氧化钾等反应剧烈。稀释后对金属有腐蚀性。
浓度较高的乙酸具有腐蚀性,能导致皮肤烧伤,眼睛永久失明以及黏膜发炎,因此需要适当的防护。上述烧伤或水泡不一定马上出现,很大部份情况是暴露后几个小时出现。乳胶手套不能起保护作用,所以在处理乙酸的时候应该带上特制的手套,例如丁腈橡胶手套。浓缩乙酸在实验室中燃烧比较困难,但是当环境温度达到39℃(102℉)的时候,它便具有可燃的威胁,在此温度以上,乙酸可与空气混合爆炸(爆炸极限4%~17%体积浓度)。
乙酸的危害和乙酸溶液的浓度有关。下表中例举了乙酸溶液的欧盟分级:
| 浓度 (质量) | 摩尔浓度 | 分级 | R-Phrases |
|---|---|---|---|
| 10%–25% | 1.67–4.16 mol/L | 刺激 (Xi) | R36/38 |
| 25%–90% | 4.16–14.99 mol/L | 腐蚀 (C) | R34 |
| >90% | >14.99 mol/L | 腐蚀 (C) | R10, R35 |
因为强烈的刺激性气味及腐蚀性蒸汽,操作浓度超过25%的乙酸要在眼罩下进行。稀乙酸溶液,例如醋,是无害的。然而,摄入高浓度的乙酸溶液是有害人及动物健康的。
泄漏处理
污染排放类别:Z
泄漏处理:切断火源,穿戴好防护眼镜、防毒面具和耐酸工作服,用大量水冲洗溢漏物,使之流入航道,被很快稀释,从而减少对人体的危害。
灭火方法
用雾状水、干粉、抗醇泡沫、二氧化碳、灭火。用水保持火场中容器冷却。用雾状水驱散蒸气,赶走泄漏液体,使稀释成为不燃性混合物。并用水喷淋去堵漏的人员。
急救
皮肤接触:皮肤接触先用水冲洗,再用肥皂彻底洗涤。
眼睛接触:眼睛受刺激用水冲洗,再用干布拭擦,严重的须送医院诊治。
吸入:若吸入蒸气得使患者脱离污染区,安置休息并保暖。
食 入:误服立即漱口,给予催吐剂催吐,急送医院诊治。
防护措施
呼吸系统防护:空气中深度浓度超标时,应佩戴防毒面具。
眼睛防护:戴化学安全防护眼镜。
手防护:戴橡皮手套。
其它:工作后,淋浴更衣,不要将工作服带入生活区。
安全信息
RTECS号:AF1225000
危险品标志:C:Corrosive
风险术语:R10
安全术语:S23
安全术语
S23Do not breathe vapour.
切勿吸入蒸汽。
S26In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
S45In case of accident or if you feel unwell, seek medical advice immediately (show the label whenever possible.)
若发生事故或感不适,立即就医(可能的话,出示其标签)。
风险术语 R10Flammable.
易燃。
R35Causes severe burns.
引起严重灼伤。
管理信息
密闭操作,加强通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(半面罩),戴化学安全防护眼镜,穿防酸碱塑料工作服,戴橡胶耐酸碱手套。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。防止蒸气泄漏到工作场所空气中。避免与氧化剂、碱类接触。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。
储存的管理
储存于阴凉、通风的库房。远离火种、热源。冻季应保持库温高于16℃,以防凝固。保持容器密封。应与氧化剂、碱类分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
运输的管理
本品铁路运输时限使用铝制企业自备罐车装运,装运前需报有关部门批准。铁路非罐装运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。运输时所用的槽(罐)车应有接地链,槽内可设孔隔板以减少震荡产生静电。严禁与氧化剂、碱类、食用化学品等混装、混运。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。
废弃的管理
用焚烧法处置。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













