-
磷
 磷
磷
磷,第15号化学元素,符号P,处于元素周期表的第三周期、第ⅤA族。磷为紫红色立方结晶或无定形粉末,具有金属光泽。
它存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,还是使心脏有规律地跳动、维持肾脏正常机能和传达神经刺激的重要物质。没有磷时,烟酸(又称为维生素B3)不能被吸收;磷的正常机能需要维生素D(维生素食品)和钙(钙食品)来维持。
目录
- 1 基本信息
2 发现简史
3 元素含量
4 物理性质
5 化学性质
6 制备方法
7 毒理性质
8 储存方法
9 应用领域
基本信息
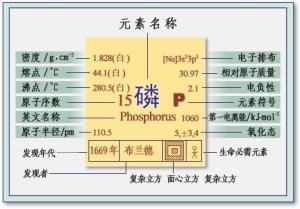
中文名:磷
沸点:590℃
危险品运输编号:UN1381/1338/2447
危险性描述:R11/16:非常易燃、与氧化物质混合会爆炸
EINECS登录:231-768-7
危险性符号:F:易燃物质
化学式:P
外观:紫红色、白色粉末
应用:红磷制造火柴、烟火及磷化合物的原料还用于灭鼠药等、白磷有毒
别称:红磷、赤磷、白磷
字词:碎石
熔点:(红磷)280ºC或(白磷)40ºC
英文名:Phosphorus
水溶性:不溶于水
CAS登录号:7723-14-0
分子量:30.973762
密度:2.2g/cm^3
安全性描述:S7/61 :保持容器紧密封闭、避免排放到环境中
闪点:30ºC
属性:化学元素
发现简史
 白磷
白磷
1669年,德国汉堡一位叫布朗特(Brand H)的商人在强热蒸发人尿的过程中,他没有制得黄金,却意外地得到一种像白蜡一样的物质,在黑暗的小屋里闪闪发光。这从未见过的白蜡模样的东西,虽不是布朗特梦寐以求的黄金,可那神奇的蓝绿色的火光却令他兴奋得手舞足蹈。他发现这种绿火不发热,不引燃其它物质,是一种冷光。于是,他就以“冷光”的意思命名这种新发现的物质为“磷”。磷的拉丁文名称Phosphorum就是“冷光”之意,它的化学符号是P,它的英文名称是Phosphorus。
元素含量
 磷
磷
元素在海水中的含量: 0.0015ppm
地壳中含量:1000ppm
磷在生物圈内的分布很广泛,地壳含量丰富列前10位,在海水中浓度属第2类。广泛存在于动植物组织中,也是人体含量较多的元素之一,稍次于钙排列为第六位。约占人体重的1%,成人体内约含有600-900g的磷。体内磷的85.7%集中于骨和牙,其余散在分布于全身各组织及体液中,其中一半存在于肌肉组织。它不但构成人体成分,且参与生命活动中非常重要的代谢过程,作为人体细胞DNA和RNA的重要组成元素,是机体很重要的一种元素。
物理性质

同位素
已发现的共有23种:包括从磷24到磷46。其中只有磷31最为稳定。其它同位素都具有放射性,其中磷32、磷33的半衰期在10d内,其余的都为极不稳定的放射性同位素。
| 符号 | 质子 | 中子 | 质量(u) | 半衰期 | 原子核自旋 | 相对丰度 | 相对丰度的变化量 |
|---|---|---|---|---|---|---|---|
| 24P | 15 | 9 | 24.03435(54)# | (1+)# | |||
| 25P | 15 | 10 | 25.02026(26)# | <30 ns | (1/2+)# | ||
| 26P | 15 | 11 | 26.01178(21)# | 43.7(6) ms | (3+) | ||
| 27P | 15 | 12 | 26.999230(28) | 260(80) ms | 1/2+ | ||
| 28P | 15 | 13 | 27.992315(4) | 270.3(5) ms | 3+ | ||
| 29P | 15 | 14 | 28.9818006(6) | 4.142(15) s | 1/2+ | ||
| 30P | 15 | 15 | 29.9783138(3) | 2.498(4) min | 1+ | ||
| 31P | 15 | 16 | 30.97376163(20) | 稳定 | 1/2+ | 1.0000 | |
| 32P | 15 | 17 | 31.97390727(20) | 14.263(3) d | 1+ | ||
| 33P | 15 | 18 | 32.9717255(12) | 25.34(12) d | 1/2+ | ||
| 34P | 15 | 19 | 33.973636(5) | 12.43(8) s | 1+ | ||
| 35P | 15 | 20 | 34.9733141(20) | 47.3(7) s | 1/2+ | ||
| 36P | 15 | 21 | 35.978260(14) | 5.6(3) s | 4-# | ||
| 37P | 15 | 22 | 36.97961(4) | 2.31(13) s | 1/2+# | ||
| 38P | 15 | 23 | 37.98416(11) | 0.64(14) s | |||
| 39P | 15 | 24 | 38.98618(11) | 190(50) ms | 1/2+# | ||
| 40P | 15 | 25 | 39.99130(15) | 153(8) ms | (2-,3-) | ||
| 41P | 15 | 26 | 40.99434(23) | 100(5) ms | 1/2+# | ||
| 42P | 15 | 27 | 42.00101(48) | 48.5(15) ms | |||
| 43P | 15 | 28 | 43.00619(104) | 36.5(15) ms | 1/2+# | ||
| 44P | 15 | 29 | 44.01299(75)# | 18.5(25) ms | |||
| 45P | 15 | 30 | 45.01922(86)# | 8# ms | 1/2+# | ||
| 46P | 15 | 31 | 46.02738(97)# | 4# ms |
备注:画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
同素异形体
- 黑磷(金属磷)
黑色有金属光泽的晶体,在磷的同素异形体中反应活性最弱,在空气中不会点燃。化学结构类似石墨,因此可导电。
化学式一般写为P。
深黑色粉末
- 白磷(黄磷)
化学式:P4
淡黄蜡似半透明可结晶的固体,于黑暗中能发光。有特臭,剧毒。密度1.83克/立方厘米,熔点44.4,沸点287度。
- 红磷(赤磷)

化学式一般写为P。
鲜红色粉末,无毒,密度2.296克/立方厘米,熔点300度,沸点725度,是黄磷于压力下稀有气体中加热8-10日而成。
- 紫磷
把黑磷加热到125℃则变成钢蓝色的紫磷 。
紫磷的化学活动性比白磷小,但仍能被硝酸氧化成磷酸。紫磷跟氯酸钾一起摩擦可以剧烈燃烧。化学结构为层状,但与黑磷不同。
化学式一般写为P。
化学性质
- 白磷
纯白磷是无色而透明的晶体,遇光逐渐变黄,因而又叫黄磷。黄磷剧毒,误食0.1g就能致死。皮肤若经常接触到单质磷也会引起吸收中毒。白磷不溶于水,易溶于CS2中。经测定,不论在溶液中或在蒸汽状态,磷的分子质量都相当于分子式P4。磷蒸汽热至1073K,P4开始分解为P2。P2分子结构和N2相同。
白磷晶体是由P4分子组成的分子晶体,P4分子呈四面体构型,分子中P—P键长是221pm,键角∠PPP是60°。理论上研究认为,P—P键是98%3p轨道形成的键(3s和3d仅占很少成分),纯p轨道间的夹角应为90°,而实际仅有60°,因此P4分子中P—P键是受了很大应力而弯曲的键。其键能比正常无应力时的P—P键要弱,易于断裂,使白磷在常温下就有很高的化学活性。
白磷在潮湿的空气中发生缓慢氧化,部分的反应能量以光能的形式放出,故在暗处可看到白磷发光。当缓慢氧化积累的能量达到燃点(313K)时便发生自燃,因此白磷通常要储存在水中以隔绝空气。
白磷和氧化剂反应猛烈,它在氯气中可自燃;遇液氯或溴会发生爆炸,与冷浓硝酸反应激烈生成磷酸;在热的浓碱液中发生歧化反应生成磷化氢(主要是PH3,还有P2H4)和次磷酸盐。
白磷的主要反应有
1.白磷在空气中自燃生成氧化物。
P4+3O2==P4O6(化合反应)
2.白磷与卤素单质剧烈反应,在氯气中也能自燃生成三氯化磷和五氯化磷。
P4+6Cl2==4PCl3(化合反应)
P4+10Cl2==4PCl5(化合反应)
3.白磷能被硝酸氧化成磷酸。
3P+5HNO3+2H2O==3H3PO4+5NO↑(氧化还原反应)
4.白磷溶解在热的浓碱中,歧化生成磷化氢和次磷酸盐。
P4+3OH-+3H2O == PH3+ 3H2PO2-
5.白磷还可以把金、银、铜和铅从它们的盐中取代出来,例如白磷与热的铜盐反应生成磷化亚铜,在冷溶液中则析出铜。
11P+15CuSO4+24H2O=△=5Cu3P+6H3PO4+15H2SO4(氧化还原反应)
2P+5CuSO4+8H2O==5Cu+2H3PO4+5H2SO4(氧化还原反应)
硫酸铜是白磷中毒的解毒剂,如不慎白磷沾到皮肤上,可用CuSO4溶液冲洗,用磷的还原性来解毒。
6.白磷可以被氢气还原生成磷化氢。
P4+6H2==4PH3
- 红磷
红磷的着火点极高,在空气中不发生自燃,但是只需要在红磷中加入少量的MnO2,片刻将会发生燃烧,在这个过程中一定需要注意安全,最好在一个安全的容器内做这个实验,否则将可能发生意外。
主要化合物
磷的氧化物有三氧化二磷和五氧化二磷。
- 三氧化二磷
磷在常温下慢慢氧化,或在不充分的空气中燃烧,均可生成P(Ⅲ)的氧化物P4O6,常称做三氧化二磷。
P4O6的生成可以看成是P4分子中的P-P键因受到O2分子的进攻而断开,在每个P原子间嵌入一个O原子而形成稠环分子。形成P4O6分子后,4个P原子的相对位置(正四面体的角顶)并不发生变化。
由于三氧化二磷的分子具有似球状的结构而容易滑动,所以三氧化二磷是有滑腻感的白色吸潮性蜡状固体,熔点296.8K,沸点(在氮气中)446.8K。
①三氧化二磷有很强的毒性,溶于冷水中缓慢地生成亚磷酸,它是亚磷酸酐。
P4O6+6H2O(冷)==4H3PO3
②三氧化二磷在热水中歧化生成磷酸和放出磷化氢:
P4O6+6H2O(热)==PH3↑+3H3PO4
③三氧化二磷易溶于有机溶剂中。
- 五氧化二磷
磷在充分的氧气中燃烧,可以生成P2O5,这个化合物常简称为五氧化二磷。其中P的氧化数为+5。
在P4O6的球状分子中,每个P原子上还有一对孤电子对,会受到O2分子的进攻,生成四个P=O双键,而形成P4O10的分子。
五氧化二磷是白色粉末状固体,熔点693K,573K时升华。它有很强的吸水性,在空气中很快就潮解,因此它是一种最强的干燥剂。
五氧化二磷与水作用激烈,放出大量热,生成P(Ⅴ)的各种含氧酸,并不能立即转变成磷酸,只有在HNO3存在下煮沸才能转变成磷酸:
P4O10+6H2O==4H3PO4(在HNO3与煮沸的条件下)
五氧化二磷是磷酸的酸酐。
- 三卤化磷
用气态的氯和溴与白磷作用可以得到PCl3和PBr3,根据理论比值混合白磷和碘在CS2中反应可以得到PI3。三氟化磷可用三氟化砷与三氯化磷的反应制备:
PCl3+ AsF3=PF3+AsCl3
磷也生成一些混合卤化物如PF2Cl和PFBr2。
- 五卤化磷
单质和卤素直接反应或三卤化物和卤素反应可以得到五卤化磷:
P4+10Cl2= 4PCl5
PF3+ Cl2= PF3Cl2
第二种方法特别适用于制备混合卤化物。
- 卤氧化磷
五卤化磷和过量的水直接接触时会迅速发生水解作用,产生磷酸和氢卤酸:
PX5+4H2O= H3PO4+5HX
如果使五卤化磷和有限量的水作用,水解产物是氢卤酸和卤氧化磷(或卤化磷先)POX3。:
PX5+H2O = POX3+2HX.
卤化氧磷是许多金属卤化物的非水溶剂,它们也能和许多金属卤化物形成配合物,如ZrCl4▪2POCl3,这种配合物应用于分离Zr和Hf。
制备方法
- 白磷
将磷酸钙、石英砂(SiO2)和炭粉的混合物放在电弧炉中熔烧还原:
2Ca3(PO4)2+6SiO2+10C=1373——1713k=6CaSiO3+P4+10CO
把生成的磷蒸气P4通过水面下冷却,就得到凝固的白色固体──白磷。
该反应的本质是碳把高氧化态的磷还原成单质磷,单纯的碳还原磷酸钙的反应需要很高的温度,加入石英砂后可大大降低反应温度。
- 红磷
 磷
磷
- 黑磷
黑磷是磷的一种最稳定的变体,但因形成它所需的活化能很高,故在一般条件下,其他变体不容易转变为黑磷,只有在1200MPa(12000atm的压力下,将白磷加热到473K方能转化类似石墨片状结构的黑磷。黑磷能导电。在磷的主要三种同素异形体中,黑磷的密度最大(2.7克每立方厘米),不溶于有机溶剂,一般不易发生化学反应。
工业上用白磷来制备高纯度的磷酸,生产有机磷杀虫剂、烟幕弹等。含有少量磷青铜叫做磷青铜,它富有弹性、耐磨、抗腐蚀,用于制作轴承、阀门等。大量红磷用于火柴生产,火柴盒侧面所涂物质就是红磷与三硫化二锑等的混合物。磷还用于制备发光二极管的半导体材料如GaASxP1-x等。
毒理性质
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗20~30 分钟。如有不适感,就医。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。如有不适感,就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。呼吸、心跳停止,立即进行心肺复苏术。就医。
食入:饮水,禁止催吐。如有不适感,就医。
消防措施
危险特性:遇明火、高热、摩擦、撞击有引起燃烧的危险。与溴混合能发生燃烧。与大多数氧化剂如氯酸盐、硝酸盐、高氯酸盐或高锰酸盐等组成爆炸性能十分敏感的化合物。燃烧时放出有毒的刺激性烟雾。
有害燃烧产物:氧化磷。
灭火注意事项及措施:小火可用干燥砂土闷熄。大火用水灭火。待火熄灭后,须用湿沙土覆盖,以防复燃。清理时须注意防范,以免灼伤。
泄漏应急措施
应急处理:消除所有点火源。隔离泄漏污染区,限制出入。建议应急处理人员戴防尘口罩,穿防毒、防静电服。禁止接触或跨越泄漏物。小量泄漏:用洁净的铲子收集泄漏物,置于干净、干燥、盖子较松的容器中,将容器移离泄漏区。大量泄漏:用水润湿,并筑堤收容。防止泄漏物进入水体、下水道、地下室或密闭性空间。
接触控制/个体防护
工程控制:密闭操作,局部排风。
呼吸系统防护:可能接触其粉尘时,应该佩戴过滤式防尘呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿一般作业工作服。
手防护:戴一般作业防护手套。
其他防护:工作现场禁止吸烟、进食和饮水。工作完毕,淋浴更衣。及时换洗工作服。
稳定性和反应性
稳定性:稳定
禁忌物:强氧化剂、酸类、酰基氯、酸酐。
避免接触条件:光照。
聚合危害:不聚合
分解产物:氮氧化物。
LD50:11.5mg/kg(大鼠经口)
废弃处置
废弃物性质:危险废物
废弃处置方法:用控制焚烧法处置。
废弃注意事项:把倒空的容器归还厂商或在规定场所掩埋。
运输信息
危规号:41001
UN 编号:1338
包装标志:易燃固体
包装类别:Ⅲ类包装
包装方法:金属容器外坚固木箱;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外普通木箱。
运输注意事项:运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。装运本品的车辆排气管须有阻火装置。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与氧化剂、卤素、卤化物、等混装混运。运输途中应防曝晒、雨淋,防高温。中途停留时应远离火种、热源。车辆运输完毕应进行彻底清扫。铁路运输时要禁止溜放。
储存方法
操作注意事项:密闭操作,局部排风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。避免产生粉尘。避免与氧化剂、卤素、卤化物接触。搬运时要轻装轻卸,防止包装及容器损坏。禁止震动、撞击和摩擦。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。库温不超过35℃,相对湿度低于80%。远离火种、热源。应与氧化剂、卤素、卤化物等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有合适的材料收容泄漏物。禁止震动、撞击和摩擦。
应用领域
 磷
磷
对人体的影响
1.磷和钙都是骨骼牙齿的重要构成材料,促成骨骼和牙齿的钙化不可缺少的营养素。有些婴儿因为缺少钙和磷,常发生软骨病或佝偻病。骨骼和牙齿的主要成分叫做磷灰石,它就是由磷和钙组成的。人到成年时,虽然骨骼已经停止生长,但其中的钙与磷仍在不断更新,每年约更新20%。也就是说,每隔5年就更新一遍。可是牙齿一旦长出后,便会失去自行修复的能力。如果儿童长牙时缺钙,牙齿就容易损坏。
2.保持体内ATP代谢的平衡。
3.磷是组成遗传物质核酸的基本成分之一,而核苷酸是生命中传递信息和调控细胞代谢的重要物质——核糖核酸(RNA)和脱氧核糖核酸(DNA)的基本组成单位。
4.参与体内的酸碱平衡的调节,参与体内能量的代谢。人体中许多酶也都含有磷。碳水化合物、脂肪、蛋白质这3种含热能的营养素在氧化时会放出热能,但这种能量并不是一下子放出来的,这其中磷在贮存与转移能量的过程中扮演着重要角色。
对植物的影响
 水稻缺磷
水稻缺磷
番茄对磷的吸收以植株生长前期为高,在第一穗果实长到核桃大小时,植株吸磷量约占全生育期90%。所以,番茄苗期不能缺磷,以免影响花芽分化。番茄吸收磷肥的能力较弱,尤其在低温下的吸收率较低。磷肥一般作基肥,也可用0.5%磷酸二氢钾溶液作叶面喷施,进行根外追肥。磷在植物体内促进氨基酸,蛋白质和碳水化合物的合成和运输,对延迟植株衰老,延长结果期,增加后期产量有良好的作用。
磷通常成正磷酸盐(磷酸氢根或磷酸二氢根)形式被植物吸收。当磷进入植物体后,大部分成为有机物,有一部分仍然保持无机盐的形式。磷以磷酸根形式存在于糖磷酸、核酸、核苷酸、辅酶、磷脂、植酸等中。磷在ATP的反应中起关键作用,磷在糖类代谢、蛋白质代谢、和脂肪代谢中起着重要的作用。
施磷能够促进各种代谢正常进行,植物生长发育良好,同时提高植物的抗寒性和抗旱性。由于磷与糖类、蛋白质和脂肪的代谢和三者相互转变都有关系,不论栽培粮食作物、豆类作物和油类作物都需要磷肥。
缺磷时,蛋白质合成受阻,新的细胞质和细胞核形成较少,影响细胞分裂,生长缓慢,分裂也少,分枝或分蘖减少,植株矮小,叶片暗绿,可能是细胞生长慢,叶绿素含量相对提高。某些植物(如油菜)叶子有时呈红色或紫色。因为缺磷阻碍了糖分运输,累积了大量的糖分,有利于黄色素苷的形成。缺磷时,开花期和成熟期都延迟,产量降低,抗性减弱。
元素间的影响
磷广泛存在于动植物组织中,并与蛋白质或脂肪结合成核蛋白、磷蛋白和磷脂等,也有少量其它有机磷和无机磷化合物。除植酸形式的磷不能被机体充分吸收和利用外,其它大都能为机体利用。谷类种子中主要是植酸形式的磷,利用率很低,但当用酵母发面时,或预先将谷粒浸泡于热水中,则可大大降低植酸磷的含量,从而提高其吸收率。若长期食用大量谷类食品,可形成对植酸的适应力,植酸磷的吸收率也可有不同程度的提高;磷的吸收,也需要维生素D。维生素D缺乏,常使血清无机磷酸盐下降,所以佝偻病患者血钙浓度往往正常,而血清无机磷含量较低。
军事用途
 白磷弹
白磷弹
白磷燃烧弹即应用此性质,是非常厉害的燃烧弹,沾到皮肤上的话很难及时去除,燃烧温度又高,可以一直烧到骨头,同时产生的烟雾对眼鼻刺激极大。最初美国人用它对付在太平洋诸岛工事里的日本人,非常有效。技术含量不大,各国军队基本都有。
白磷弹基本结构,就是在弹体内充填磷药,遇空气即开始自燃直到消耗完为止。完整的白磷弹由弹底、炮弹底塞、塑料垫圈、起爆药、起爆药室、黄磷发烟罐、铝质隔片、弹体、销针、限位器、保险与解除保险装置、延期雷管、抛射药和机械时间瞬发引信组成。
例如:MK·77白磷炮弹是一种攻击型燃烧武器,功能与喷火器相似,弹体内含有大量粘稠剂,能粘在人体和装备上燃烧,通常用于打击裸露或易燃目标,杀伤效果极佳,曾被1980年通过的《联合国常规武器公约》列为违禁武器,不允许对平民或在平民区使用。尽管美国没有签署该公约,似乎可不受其制约,但作为一项被80多个国家所接受的国际性公约,其普遍性和合法性已毋容置疑,而美国作为国际社会的一员,理应自觉遵守,否则就会引起国际公愤,陷己于孤立境地。
白磷炮弹主要用作燃烧弹某些情况下也可代替照明弹,二战末期各国陆军就开始使用了,美军似乎是放在化学迫击炮连内.
烟幕弹中装有白磷,当其引爆后,白磷会在空气中迅速燃烧:4P+5O2=== ( 点燃 ) 2P2O5生成物P2O5. 后与空气中的水分以生化学反应:P2O5+H2O====2HPO3(偏磷酸),P2O5+3H2O===2H3PO4(磷酸),这些酸液微滴与一部分未发生反应的白色小颗粒状P2O5悬浮在空气中便形成了烟雾。
处白磷燃烧弹作用范围,最有效方法是全身浸入水中隔绝空气,降低温度。对于伤处,应立即进行外科处理(将伤处切除)。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













