-
化学能
 化学能
化学能
化学能是一种很隐蔽的能量,它不能直接用来 做功,只有在发生 化学变化的时候才可以释放出来,变成热能或者其他形式的能量。像石油和 煤的 燃烧,炸药爆炸以及人吃的食物在体内发生化学变化时候所放出的能量,都属于化学能。化学能是指储存在物质当中的能量,根据 能量守恒定律,这种能量的变化与反应中热能的变化是大小相等、符号相反,参加反应的化合物中各原子重新排列而产生新的化合物时,将导致化学能的变化,产生 放热或 吸热效应。
目录
- 1 基本信息
2 基础定义
3 电离能
4 能量转换
基本信息
中文名:化学能
拉丁文名:Donec eu
解释:物体发生化学反应时所释放的能量
见载刊物:化学名词科学出版社
外文名:chemical energy
属性:能量的一种
拼音:huà xué néng
公布时间:1991年
基础定义
 化学能
化学能
原子是由 原子核和电子靠 电磁场粘合而成的,分子是由原子靠电磁场( 化学键能)粘合而成的,物体(固体液体气体,非生物和生物)是由分子靠电磁场(分子间力)粘合而成的。化学键是物质的一种存在形式,化学键物质就是电磁场物质。化学反应是原子重新组合变成新的物质的过程。在化学反应过程中,化学键的 键能 能级发生变化,于是产生化学能现象。键能(电磁场能级)提高时是吸能反应,键能降低时是放能反应。
化学键的断裂和形成是物质在 化学变化中发生能量变化的主要原因。所以说,物质的 化学反应与体系的能量变化是同时发生的。
主要作用
各种物质都储存有化学能。不同的物质不仅组成不同、结构不同,所包含的化学能有不同。在 化学反应中,既有化学物中 化学键的断裂,又有生成物中化学键的形成,那么,一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于 反应物的总能量于生成物的总能量的相对大小。
电离能
基态的 气态 原子失去一个电子形成气态一价 正离子时所需能量称为元素的 第一电离能(I1)。元素气态一价正离子失去一个电子形成气态二价正离子时所需能量称为元素的第二电离能(I2)。第三、四电离能依此类推,并且I1<I2<I3…。由于原子失去电子必须消耗能量克服核对外层电子的引力,所以电离能总为正值,SI单位为J/ mol-1,常用kJ/mol-1。通常不特别说明,指的都是第一电离能.
第一电离能
气态 电中性基态原子失去一个电子,转化为 气态基态 正离子所需要的最低能量叫第一电离能。 “气态”、“电中性”、“ 基态”是保证最低能量的条件。 1.总体上金属元素第一电离能较小非金属元素第一电离能较大. 2.同周期元素第一电离能从左到右有增大的趋势 3.同主族元素第一电离能从上到下逐渐减小 4.同一周期第一电离能最小的是 碱金属元素,最大的是惰性气体元素 电离能。
能量转换
化学反应在反应前后遵循质量守恒定律;同样,一种能量可以转化为另一种能量,能量也是守恒的,这就是“能量守恒定律”
实际应用
人类不但利用化学能转化为热能的原理来获取所需的热量进行生活、生产和科研,如化石燃料的燃烧、炸药开山、发射火箭等。化学家们也常常利用热能使很多化学反应得以发生,从而探索物质的组成、性质或制备所需的物质,如高温冶炼金属、分解化合物等。
意义
化学反应伴随着能量变化是化学反应的一大特征。化学物质中的化学能通过化学反应转化成热能,是人类生存和发展的动力之源;而热能转化为化学能又是人们进行化学科学研究,创造新物质不可缺少的条件和途径。
1、ATP 提供生命活动所需能量
2、热能 维持体温恒定
转生物能
“呼吸”是指生物体吸入氧气和呼出二氧化碳的过程,而“细胞呼吸”是指细胞内有机物氧化分解释放能量的过程。
呼吸类型
有氧呼吸:(在酶的作用下)
C6H12O6+6H2O+6O2→6CO2+ 12H2O+能量
1mol葡萄糖释放2870KJ,有1161KJ转移至ATP(合成38molATP),能量效率高达40%,其余主要以热能(1709KJ)的形式散失掉。
无氧呼吸:(在酶的作用下)
C6H12O6→2C2H5OH + 2CO2+ 能量
C6H12O6→2C3H6O3+ 能量
1mol葡萄糖分解成乳酸释放196.65KJ能量,有61.08KJ转移至ATP(合成2molATP),其余以热能的形式散失掉。
转电能
化学能转化为电能的方式:
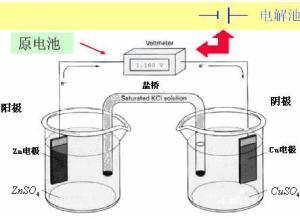
原电池将化学能直接转化为电能 优点:清洁、高效
电池原理
1、概念:把化学能直接转化为电能的装置叫做原电池。
2、原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。
3、构成原电池的条件:(1)电极为导体且活泼性不同;(2)两个电极接触(导线连接或直接接触);(3)两个相互连接的电极插入电解质溶液构成闭合回路。
4、电极名称及发生的反应:
负极:
较活泼的金属作负极,负极发生氧化反应,
电极反应式:较活泼金属-ne-=金属阳离子
负极现象:负极溶解,负极质量减少。
正极:
较不活泼的金属或石墨作正极,正极发生还原反应,
电极反应式:溶液中阳离子+ne-=单质
正极的现象:一般有气体放出或正极质量增加。
主要类型
1、干电池:活泼金属作负极,被腐蚀或消耗。如:Cu-Zn原电池、锌锰电池。
2、充电电池:两极都参加反应的原电池,可充电循环使用。如铅蓄电池、锂电池和银锌电池等。
3、燃料电池:两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应,如H2、CH4燃料电池,其电解质溶液常为碱性试剂(KOH等)。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。













