-
盐酸
 盐酸
盐酸
盐酸(hydrochloric acid)是氯化氢(HCl)的水溶液,为无色透明的液体。
盐酸属于一元无机强酸,工业用途广泛。有强烈的刺鼻气味,具有较高的腐蚀性,浓盐酸的质量分数约为37%,具有极强的挥发性。
目录
- 1 基本信息
2 研究简史
3 理化性质
4 制备方法
5 应用领域
6 安全措施
7 检测方法
8 储存运输
基本信息
中文名:盐酸
别称:氢氯酸
分子量:36.5
EINECS登录:231-595-7
沸点:110℃(383K,20.2%溶液);48℃(321K,38%溶液)
密度:1.18g/cm3
闪点:不可燃
危险性描述:有腐蚀性
摩尔质量:36.46 g·mol⁻¹
酸度系数:-8.0
警示术语:R:R34, R37
欧盟编号:017-002-01-X
英文名:Chloran;Hydrochloric Acid
化学式:HCl(aq)
CAS登录号:7647-01-0
熔点:-27.32℃(247K,38%溶液)
水溶性:混溶
外观:无色至淡黄色清澈液体
应用:提取精盐
危险品运输编号:1789
ATC代码:A09AB03、B05XA13
黏度:1.9 mPa·s(25℃,31.5%溶液)
安全术语:S:S1/2, S26, S45
主要危害:腐蚀性
研究简史
 盐酸
盐酸
16世纪,利巴菲乌斯第一次正式 记载了分离出的纯净盐酸,他是在粘土 坩埚中加热盐与 浓硫酸的混合物来制备它的。也有一些作者认为纯的盐酸是由15世纪德国 本笃会的巴希尔·瓦伦丁制备的 ,他的方法是将 食盐与 硫酸亚铁混合加热后酸化 。不过,其他一些作者认为直到16世纪末都没有文献明确表明有人制备过纯的盐酸 。
17世纪,德国卡尔施塔特县的约翰·格劳勃通过曼海姆法加热 氯化钠和硫酸来制备 硫酸钠,并释放出了 氯化氢气体。1772年英国 利兹的 约瑟夫·普利斯特里制出了纯的氯化氢气体。1808年,英国彭赞斯的 汉弗里·戴维证明了氯化氢气体由 氢、 氯两种元素组成 。
工业革命期间,欧洲对 碱的需求有所增加。法国伊苏丹的尼古拉斯·勒布朗新发现了一种 碳酸钠(苏打)工业制法,使碳酸钠得以大规模廉价生产。勒布朗制碱法用 硫酸、 石灰石、 煤将食盐转变为苏打,同时生成副产物氯化氢气体。这些氯化氢大多排放到空气中,直到各国出台相关法规(例如英国《1863年碱类法令》)后,苏打生产商们才用水吸收氯化氢,使得盐酸在工业上大量生产。
20世纪,无盐酸副产物的 氨碱法已经完全取代勒布朗法。这时盐酸已成为许多化工应用中很重要的一种化学品,因而人们开发了许多其他的制备方法,其中一些至今仍在使用。2000年后,绝大部分盐酸都是由工业生产有机物得到的副产品氯化氢溶于水而得到的。
1988年,因为盐酸常用于制备 海洛因、 可卡因、 甲基苯丙胺等毒品,《 联合国禁止非法贩运麻醉药品和精神药物公约》将其列入了表二- 前体中。
理化性质
盐酸是无色液体(工业用盐酸会因有杂质三价铁盐而略显黄色),为 氯化氢的水溶液,具有刺激性气味,一般实验室使用的盐酸为0.1mol/L,pH=1。由于浓盐酸具有挥发性,挥发出的氯化氢气体与空气中的 水蒸气作用形成盐酸小液滴,所以会看到白 雾。 盐酸与水、乙醇任意混溶,浓盐酸稀释有热量放出,氯化氢能溶于 苯。
20℃时不同浓度盐酸的 物理性质数据:
| 盐酸在一定压力下能形成共沸溶液。下图为一个大气压下不同浓度盐酸的沸点,其中下方的线与上方的线分别表示相应温度下,液体及与液体处于平衡状态的蒸气的组分。氯化氢的质量分数20.24%对应最高沸点108.6℃。 化学性质酸性 盐酸溶于碱液时与碱液发生中和反应。 盐酸是一种 一元强酸,这意味着它只能 电离出一个
。在水溶液中氯化氢分子完全电离,
与一个水分子络合,成为H 3O +,使得水溶液显酸性:
可以看出,电离后生成的阴离子是Cl -,所以盐酸可以用于制备 氯化物,例如 氯化钠。 盐酸可以与氢氧化钠酸碱中和,产生食盐:
稀盐酸能够溶解许多金属( 金属活动性排在 氢之前的),生成金属氯化物与 氢气:
铜、 银、 金等活动性在氢之后的金属不能与稀盐酸反应,但铜在有空气存在时,可以缓慢溶解 ,例如:
高中化学把盐酸和 硫酸、 硝酸、 氢溴酸、 氢碘酸、 高氯酸合称为六大无机强酸。 一元酸只有一个酸离解常数,符号为 K a。它能够度量水溶液中酸的强度。于盐酸等强酸而言, K a很大,只能通过理论计算来求得。向盐酸溶液中加入氯化物(比如NaCl)时 pH基本不变,这是因为Cl -是盐酸的 共轭碱,强度极弱。所以在计算时,若不考虑极稀的溶液,可以假设氢离子的 物质的量浓度与原氯化氢浓度相同。如此做即使精确到四位 有效数字都不会有误差。 还原性 盐酸具有 还原性,可以和一些强氧化剂反应,放出氯气: 二氧化锰:
二氧化铅:
一些有氧化性的碱和盐酸可以发生 氧化还原反应,而不是简单的 中和反应: 配位性 部分金属化合物溶于盐酸后,金属离子会与氯离子 络合。例如难溶于冷水的 二氯化铅可溶于盐酸:
铜在无空气时难溶于稀盐酸,但其能溶于热浓盐酸中,放出氢气:
有机化学 酸性环境下可对醇类进行亲核取代生成卤代烃:
氯化氢也可以加成烯双键得到氯代烃,例如:
胺类化合物通常在水中溶解度不大。欲增大其溶解度,可以用稀盐酸处理为 铵盐:
胺的盐酸盐属于 离子化合物,根据 相似相溶原理,在水中的溶解度较大。铵盐遇到强碱即可变回为胺:
利用这样的性质,可以将胺与其他有机化合物分离 。 此外,胺的盐酸盐的 熔点或分解点可以用来测定胺的种类。 锌粒与 氯化汞在稀盐酸中反应可以制得 锌汞齐,后者与浓盐酸、 醛或 酮一起回流可将醛酮的 羰基还原为 亚甲基,是为 克莱门森还原反应:
但应注意,此法只适用于对酸稳定的化合物,如果有α、β-碳碳双键等也会被还原:
无水 氯化锌溶于高浓度 盐酸可以制得 卢卡斯试剂,用来鉴别六碳及以下的醇是 伯醇、 仲醇还是 叔醇。 将卢卡斯试剂与叔醇立即浑浊,与仲醇2-5分钟浑浊,伯醇加热浑浊。
制备方法工业制法 电解法 工业制备盐酸主要采用 电解法。 1、将饱和食盐水进行 电解,除得 氢氧化钠外,在阴极有 氢气产生,阳极有 氯气产生:
2、在反应器中将氢气和氯气通至 石英制的烧嘴点火燃烧,生成 氯化氢气体,并发出大量热:
3、氯化氢气体冷却后被水吸收成为盐酸。 在氯气和氢气的反应过程中,有毒的氯气被过量的氢气所包围,使氯气得到充分反应,防止了对空气的污染。在生产上,往往采取使另一种原料过量的方法使有害的、价格较昂贵的原料充分反应。 有机反应副产物 其他反应的副产物产生氯化氢,例如 烃类的氯化,或 有机氯化合物的 脱卤反应等
制法之二实验室制法 盐酸主要由 氯化氢溶于水来制备。而氯化氢又有多种制备的方式,所以有许多 前体。另外,也可以通过 氯气与 二氧化硫在水溶液中作用来制备:
用 重水水解氯化物(如 三氯化磷、 二氯亚砜等)或 酰氯,可以得到含有 氘的盐酸:
应用领域
人类和其他动物的 胃壁上有一种特殊的 腺体,能把吃下去的食盐变成盐酸。盐酸是胃液的一种成分(浓度约为0.5%),它能使胃液保持激活胃 蛋白酶所需要的最适合的 pH值,它还能使食盐中的蛋白质变性而易于 水解,以及杀死随食物进入胃里的细菌的作用。此外,盐酸进入小肠后,可促进胰液、肠液的分泌以及胆汁的分泌和排放,酸性环境还有助于小肠内铁和钙的吸收。
利用盐酸可以与难溶性碱反应的性质,制取 洁厕灵、 除锈剂等日用品。 工业用途盐酸是一种无机强酸,在工业加工中有着广泛的应用,例如金属的精炼。盐酸往往能够决定产品的质量。 分析化学 在 分析化学中,用酸来测定 碱的浓度时,一般都用盐酸来 滴定。用强酸滴定可使终点更明显,从而得到的结果更精确。在1 标准大气压下,20.2%的盐酸可组成恒沸溶液,常用作一定 气压下 定量分析中的 基准物。其恒沸时的浓度会随着气压的改变而改变。 盐酸常用于溶解固体样品以便进一步分析,包括溶解部分金属与 碳酸钙或 氧化铜等生成易溶的物质来方便分析。 酸洗钢材 盐酸一个最重要的用途是 酸洗钢材。在后续处理铁或钢材( 挤压、 轧制、 镀锌等)之前,可用盐酸反应掉表面的锈或 铁氧化物。通常使用浓度为18%的盐酸溶液作为酸洗剂来清洗 碳钢:
剩余的废酸常再用作 氯化亚铁溶液,但其中 重金属含量较高,故这种做法已经逐渐变少。 酸洗钢材工业发展了盐酸再生工艺,如喷雾焙烧炉或流化床盐酸再生工艺等。这些工艺能让氯化氢气体从酸洗液中再生。其中最常见的是高温水解工艺,其反应方程式如下:
将制得的氯化氢气体溶于水即又得到盐酸。通过对废酸的回收,人们建立了一个封闭的酸循环。副产品 氧化铁在各种工业加工流程中也有较多应用。 制备有机化合物 盐酸的另一大主要用途是制备 有机化合物,例如合成 PVC塑料的原料 氯乙烯、 二氯乙烷、 聚碳酸酯的前体 双酚A、催化胶黏剂 聚乙烯醇缩甲醛、 抗坏血酸等。企业合成PVC时通常不用市售的,而使用内部制备的盐酸。盐酸在制药方面也有很大的用途。 如制备氯乙烯的反应:
制备无机化合物 盐酸可以发生酸碱反应,故能制备许多 无机化合物,例如处理水所需的化学品 氯化铁与 聚合氯化铝(简称聚铝,PAC):
(用 赤铁矿制备氯化铁) 氯化铁与聚铝在 污水处理、 纸、 饮用水等的生产中起 絮凝剂和混凝剂的作用。 用盐酸还可以制备其他的无机物,包括道路用盐 氯化钙、 电镀用盐 氯化镍、镀锌工业和 电池制造业用盐 氯化锌等。另外,常通过氯化锌 活化法从木炭制备 活性炭。
(用 石灰石制备氯化钙) 控制pH及中和碱液 盐酸可以用来调节溶液的 pH值:
在工业中对纯度的要求极高时(如用于食品、制药及饮用水等),常用高纯的盐酸来调节水流的pH;要求相对不高时,工业纯的盐酸已足以 中和废水,或处理游泳池中的水。 用于焰色反应 用于检验金属或它们的化合物时常使用焰色反应,用于检验的铂丝需用稀盐酸洗净以除去杂质元素的影响。 检验物质前,应将铂丝用盐酸清洗,再放到火焰上灼烧,直到火焰呈原来颜色方可实验。 阳离子交换树脂的再生 高质量的盐酸常用于 阳离子交换树脂的再生。 阳离子交换广泛用于 矿泉水生产中,除去 溶液中含有的
、
等 离子,而盐酸可以冲掉反应后树脂中的这些离子。一个
替换一个
,
则需要两个
。 离子交换树脂和 软化水在几乎所有的化学工业中都有应用,尤其是饮用水生产和食品工业。 其他应用 盐酸还有许多小规模的用途,比如 皮革加工、食盐生产,以及用于建筑业 。 石油工业也常用盐酸:将盐酸注入 油井中以溶解岩石,形成一个巨大的空洞。此法在 北海油田的石油开采工业中经常用到。 盐酸可以溶解碳酸钙,其应用包括除 水垢或砌砖使用的 石灰砂浆,但盐酸较为危险,使用时需谨慎。它与石灰砂浆中的碳酸钙反应生成 氯化钙、 二氧化碳和水:
在 明胶、食品、食品原料和 食品添加剂的生产中常用到盐酸。典型例子有 阿斯巴甜、 果糖、 柠檬酸、 赖氨酸、酸水解植物蛋白等。这些工艺都使用食品级(非常纯)的盐酸。 安全措施浓盐酸(发烟盐酸)会挥发出酸雾。盐酸本身和酸雾都会腐蚀人体组织,可能会不可逆地损伤呼吸器官、眼部、皮肤和胃肠等。在将盐酸与 氧化剂(例如漂白剂 次氯酸钠或 高锰酸钾等)混合时,会产生有毒气体 氯气。
人们常穿戴个人防护装备来减少处理盐酸带来的危害,包括 乳胶手套 、 护目镜、耐腐蚀的服装与鞋等。 美国国家环境保护局已将盐酸定为 有毒物质。 氯化氢的危险性取决于其浓度。下表中列出欧盟对盐酸溶液的分类。
危害防治操作事项 使用盐酸时,应配合个人防护装备。如橡胶手套或 聚氯乙烯手套、护目镜、耐化学品的衣物和鞋子等,以降低直接接触盐酸所带来的危险。密闭操作,注意通风。操作尽可能机械化、自动化。操作人员必须经过专门培训,严格遵守操作规程。 建议操作人员佩戴自吸过滤式防毒面具(全面罩),穿 橡胶耐酸碱服,戴橡胶 耐酸碱手套。远离易燃、可燃物。防止蒸气泄漏到工作场所空气中。避免与碱类、 胺类、 碱金属接触。搬运时要轻装轻卸,防止 包装及容器损坏。配备 泄漏应急处理设备。倒空的容器可能残留有害物。 酸雾处理 在盐酸使用过程中,有大量氯化氢气体产生,可将吸风装置安装在容器边,再配合风机、 酸雾净化器、风道等设备设施,将盐酸雾排出室外处理。也可在盐酸中加入酸雾 抑制剂,以抑制盐酸酸雾的挥发产生。 泄漏应急处理 应急处理:迅速撤离泄漏污染区人员至 安全区,并进行隔离,严格限制出入。建议应急处理人员戴自给 正压式呼吸器,穿防酸碱工作服。不要直接接触泄漏物。尽可能切断泄漏源。 小量泄漏:用砂土、干燥 石灰或苏打灰混合。也可以用大量水冲洗,清水稀释后放入 废水系统。 大量泄漏:构筑围堤或挖坑收容。用泵转移至 槽车或专用收集器内,回收或运至废物处理场所处置。 消防措施 危险特性:能与一些活性金属粉末发生反应, 放出氢气。遇氰化物能产生剧毒的氰化氢气体。与碱发生 中和反应,并放出大量的热。具有较强的腐蚀性。 有盐酸存在时的灭火方法:用碱性物质如 碳酸氢钠、碳酸钠、 消石灰等中和。也可用大量水扑救。 急救措施 皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟,可涂抹 弱碱性物质(如碱水、肥皂水等),就医。
眼睛接触: 立即提起 眼睑,用大量流动清水或 生理盐水彻底冲洗至少15分钟。就医。 吸入:迅速脱离现场至空气新鲜处。保持 呼吸道通畅。如 呼吸困难,给输氧。如呼吸停止,立即进行 人工呼吸。就医。 食入:用大量水漱口,吞服大量生鸡蛋清或牛奶(禁止服用小苏打等药品),就医。 安全标志盐酸具有强腐蚀性,容器上需要标注腐蚀品的标志。 检测方法中和滴定法 应用范围本方法采用 滴定法测定盐酸中氯化氢的含量。本方法适用于盐酸。 方法原理供试品用水稀释,加甲基红指示液,用氢氧化钠滴定液滴定。甲基红指示液变红时停止滴定,读出氢氧化钠滴定液使用量,计算盐酸含量。 主要试剂1、蒸馏水(新沸放冷) 2、 氢氧化钠滴定液(1mol/L) 3、 甲基红指示液 4、基准 邻苯二甲酸氢钾 试样制备1. 氢氧化钠滴定液(1mol/L) 配制:取澄清的氢氧化钠饱和溶液56mL,加新沸过的冷水使成1000mL。 标定:取在105℃干燥至恒重的基准邻苯二甲酸氢钾约6g,精密称定,加新沸过的冷水50mL,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定,在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。每1mL氢氧化钠滴定液(1mol/L)相当于204.2mg的邻苯二甲酸氢钾。根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。 贮藏:置 聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。 2. 甲基红指示液 取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4mL使溶解,再加水稀释至200mL,即得。 操作步骤取该品约3mL,置贮有水20mL并称定重量的具塞锥形瓶中,精密称定,加甲基红指示液2滴,用氢氧化钠滴定液(1mol/L)滴定,每1mL氢氧化钠滴定液(1mol/L)相当于36.46mg的HCl。 注 :“精密称取”系指称取重量应准确至所称取重量的千分之一,“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精度要求。 储存运输储存于阴凉、通风的库房。库温不超过30℃,相对湿度不超过85%。保持容器密封。应与碱类、胺类、碱金属、易(可)燃物分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。 盐酸的 联合国危险货物编号是1789,在装它的容器上需要注明这个编号。 废弃处置方法: 用碱液- 石灰水中和,生成氯化钠和氯化钙,用水稀释后排入废水系统。 运输方法
UN编号: 1789 包装类别: O52 包装方法:耐酸坛或陶瓷瓶外普通木箱或半花格木箱;玻璃瓶或塑料桶(罐)外普通木箱或半花格木箱;磨砂口玻璃瓶或螺纹口玻璃瓶外普通木箱;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外普通木箱。 运输注意事项: 本品铁路运输时限使用有像胶衬里钢制罐车或特制塑料企业自备罐车装运,装运前需报有关部门批准。铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与碱类、胺类、碱金属、易燃物或可燃物、食用化学品等混装混运。运输时运输车辆应配备泄漏应急处理设备。运输途中应防曝晒、雨淋,防高温。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。 1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
精彩人物 |
|---|
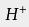
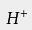
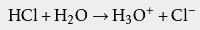
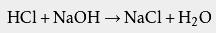

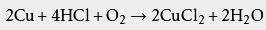
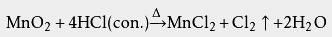
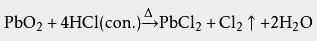
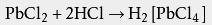
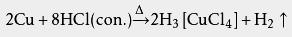
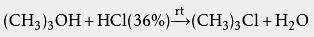

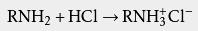
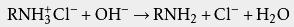
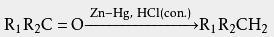
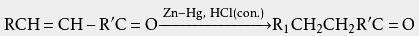
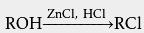
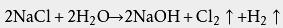
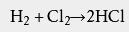
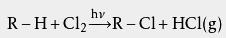

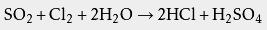
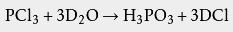
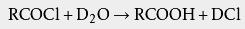
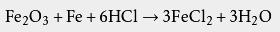
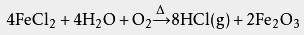
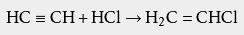
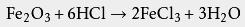
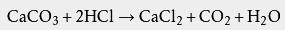
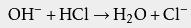
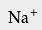
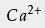
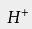
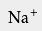
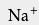
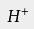
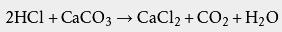
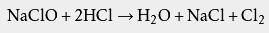
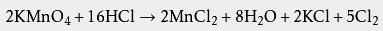
 盐酸
盐酸
 盐酸
盐酸












